EXEMPLE liaison covalente non polaire. liaison covalente polaire et non polaire
Un rôle important dans le niveau chimique de l'organisation du monde joue un mode de particules structurées de communication, entre les composés. Le grand nombre de substances simples, à savoir non métalliques sont de type de liaison covalente non polaire, à l' exception des gaz inertes. Les métaux sous forme pure ont méthode de communication particulière qui est réalisée par la socialisation des électrons libres dans le réseau cristallin.
Toutes les substances complexes (à l'exception de certaines organique) sont des liaisons chimiques covalentes polaires. Les types et les exemples de ces composés sont discutés ci-dessous. En attendant, connaître les caractéristiques d'un atome affecte la polarisation de communication.
électronégativité
Atomes, et plus particulièrement son noyau (qui, comme on le sait, sont chargés positivement), ont la capacité d'attirer et de retenir la densité d'électrons, en particulier, la formation de liaisons chimiques. Cette propriété a été appelé électronégativité. Le tableau périodique sa valeur augmente au cours des périodes ainsi que les principaux éléments des sous-groupes. valeur électronégativité est pas toujours constante et peut varier, par exemple, changer le type d'hybridation, qui pénètrent dans les orbitales atomiques.
des liaisons chimiques, les types et les exemples sont énumérés ci – dessous, et plus spécifiquement, la localisation ou déplacement partiel de ces contacts à l' un des participants de liaison est expliquée par la caractéristique électronégatif d'un élément particulier. Le déplacement se produit à l'atome, qui est plus forte.
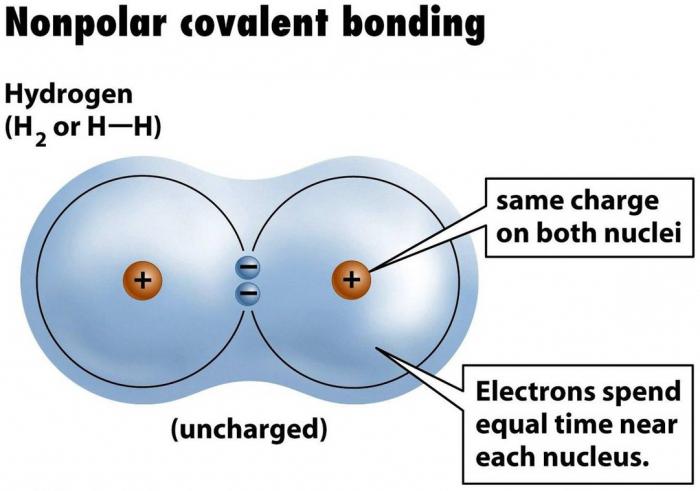
liaison covalente non polaire
« Formula » liaisons covalentes non polaires simples – deux atomes de même nature sont combinés ensemble dans une paire d'électrons leurs coquilles de valence. Une telle paire est appelée divisée parce qu'il appartient aux deux parties tout aussi contraignantes. Il est par la socialisation densité d'électrons sous la forme d'une paire d'électrons, les atomes se déplacent dans un état stable, étant donné que le niveau de leur électronique externe complète, et « octet » (ou « doublet » dans le cas d'une substance simple de l' hydrogène H 2, il ne s-orbital, pour réalisation de deux électrons qui a besoin) – un état de niveau externe, à laquelle tous les atomes, car elle correspond à l'état de remplissage avec un minimum d'énergie. 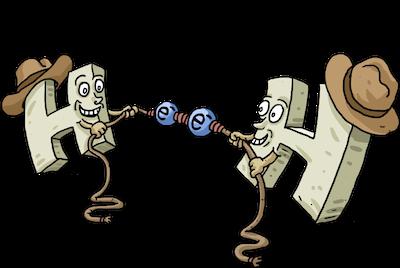
Un exemple d'une liaison covalente non polaire est dans les matières inorganiques et, aussi étrange que cela puisse paraître, mais aussi en chimie organique, aussi. Ce type de connexion est commun à toutes les substances simples – non-métaux autres que les gaz nobles, que le niveau de valence de l'atome de gaz inerte et a déjà terminé octet d'électrons, et donc avec la même liaison elle-même n'a pas de sens pour lui, et encore moins énergétiquement favorable. En la matière organique non-polarité trouvée dans une structure particulière de la molécule et est conditionnelle.
liaison covalente polaire
EXEMPLE liaison covalente non polaire limitée à quelques molécules d'une substance simple, tandis que les composés de dipôles dans lequel la densité d'électrons est partiellement décalée vers un élément plus électronégatif, – une majorité écrasante. Toute combinaison d'atomes avec une valeur différente de électronégativité donne lien polaire. En particulier, en raison de la matière organique – une liaison covalente polaire. Parfois, des oxydes inorganiques ioniques sont également polaires, et les sels d'acides et de type liaison ionique prédomine.
Comme un cas extrême de la liaison polaire parfois traités et les composés de type ionique. Si l'électronégativité de l'un des éléments est sensiblement plus élevé que l'autre, une paire d'électrons est complètement décalé du centre de la communication à celle-ci. Donc, il y a une division en ions. Toute personne qui prend une paire d'électrons, est converti en un anion et reçoit une charge négative, et la perte d'un électron – se transforme en un cation et devenir positif. 
Des exemples de substances inorganiques avec un type de liaison covalente non polaire
Les substances ayant une liaison covalente apolaire – est, par exemple, toutes les molécules de gaz binaires: un atome d'hydrogène (H – H), d'oxygène (= O), l'azote (dans sa molécule 2 atomes liés triple liaison (N ≡ N)); des liquides et des substances solides: chlore (Cl – Cl), fluoro (F – F), bromo (Br – Br), l'iode (I – I). substances aussi complexes constitués d'atomes d'éléments différents, mais avec la même valeur réelle de l' électronégativité, par exemple, l' hydrure de phosphore – PH 3.
Organique et la liaison non polaire
Très clair que toute la matière organique complexe. La question est, comment peut-il y avoir un lien non polaire dans une affaire complexe? La réponse est assez simple, si un peu la pensée logique. Si les valeurs d'électronégativité éléments liés diffèrent légèrement et ne créent pas un moment dipolaire dans le composé, cette connexion peut être considérée comme non polaire. Tel est le cas avec du carbone et de l'hydrogène: les liaisons C – H dans la matière organique sont considérés comme étant non polaire.
EXEMPLE liaison covalente non polaire – molécule de méthane, le plus simple composé organique. Il se compose d'un atome de carbone qui, selon sa valence, relié par des liaisons simples à quatre atomes d'hydrogène. En fait, la molécule est pas un dipôle, car il n'y a pas de localisation de charge dans quelque chose et au détriment de la structure tétraédrique. La densité électronique est répartie uniformément. 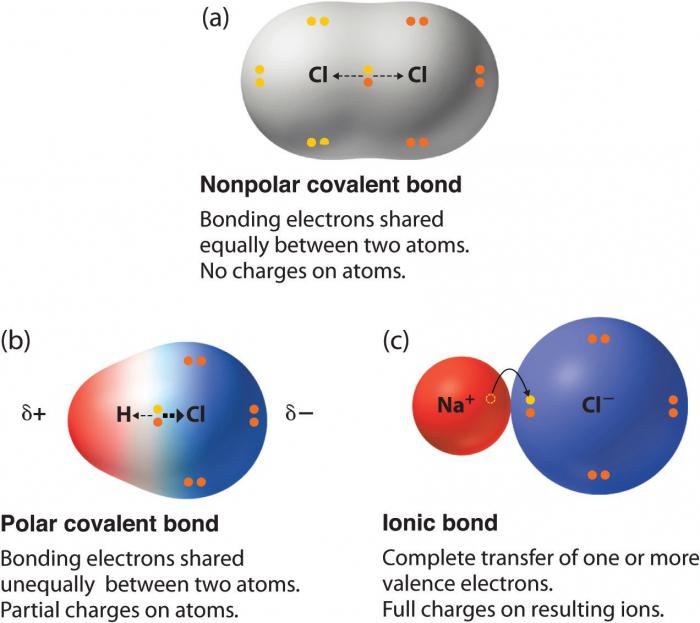
Un exemple d'une liaison covalente non polaire est en composés organiques plus complexes. Il est réalisé aux dépens des effets mésomères, qui est, densité constante électronique de traction, qui a rapidement éteint par la chaîne de carbone. Ainsi, dans la molécule de liaison hexachloroéthane C – C non polaire en raison de la densité d'électrons de traction uniforme six atomes de chlore.
D'autres types d'obligations
En plus d'une liaison covalente, qui, d'ailleurs, peut être effectuée sur le mécanisme donneur-accepteur, il y a des liaisons ioniques, métalliques et d'hydrogène. caractéristiques brèves avant-dernière deux présentées ci-dessus. 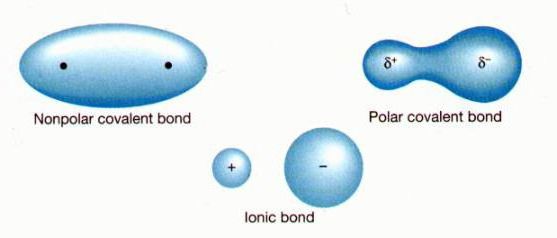
liaison d'hydrogène – est l'interaction intermoléculaire électrostatique, ce qui peut se produire lorsqu 'il y a un atome dans la molécule et aucun autre de l'hydrogène ayant des paires d'électrons non partagées. Ce type de liaison est beaucoup plus faible que les autres, mais en raison du fait que la substance de ces obligations peut être formé beaucoup, contribue de manière significative aux propriétés du composé.













