Ozone – un bleu de gaz. Propriétés et application de gaz. Ozone dans l'atmosphère
Ozone – un gaz. Contrairement à beaucoup d'autres, il n'est pas transparent, et a une couleur distinctive et même odeur. Il est présent dans l'atmosphère et est l'un de ses éléments les plus importants. Quelle est la densité de l'ozone, sa masse et d'autres propriétés? Quel est son rôle dans la vie de la planète?
gaz bleu
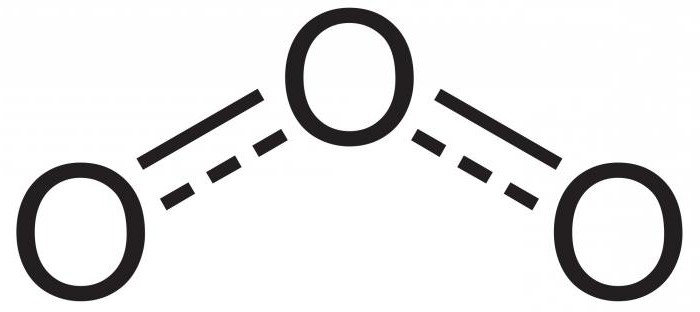
La chimie de l'ozone n'est pas un siège dans le tableau périodique. En effet, ce n'est pas un élément. Ozone – il modification allotropique ou variation d'oxygène. Comme dans D2, sa molécule ne se compose que d'oxygène, mais ne pas deux, mais trois. Il ressemble donc à une formule chimique O3.
gaz d'ozone est bleu. Il a une odeur piquante bien visible, qui rappelle le chlore, si la concentration est trop élevée. Vous souvenez-vous l'odeur de fraîcheur sous la pluie? Ceci est l'ozone. En raison de cette propriété, et il a obtenu son nom, parce que la langue grecque ancienne « Ozone » – une « odeur ».
molécule de gaz atomes polaires qui y sont connectés sous un angle de 116,78 °. L'ozone est produit lorsque la molécule O2 est fixé à un oxygène libre. Cela se produit au cours des diverses réactions telles que l'oxydation du phosphore, décharge électrique ou de la décomposition des peroxydes dans lesquels les atomes d'oxygène et enlevé.
propriétés de l'ozone
Dans des conditions normales, il existe l' ozone dans un gaz ayant un poids moléculaire d'environ 48 g / mol. Il est diamagnétique, ce n'est pas en mesure d'être attiré par un aimant, tout comme l'argent, l'or ou de l'azote. la densité de l'ozone est 2,1445 g / dm³.
Dans l'ozone solide devient bleu-noir, liquide – couleur indigo proche de violet. Point d'ébullition dans ce cas est de 111,8 degrés Celsius. A une température de zéro degré, il est soluble dans l'eau (seulement pur) dix fois plus d'oxygène. Il est bien mélangé avec le méthane liquide, l' azote, le fluor, l' argon, et dans certaines conditions et avec de l' oxygène.

Sous l'action d'un certain nombre de catalyseurs est facilement oxydé, tout en insistant sur les atomes d'oxygène libres. Connexion avec lui, il a enflammé immédiatement. La substance capable d'oxyder presque tous les métaux. Ils ne se prêtent pas à son action que le platine et l'or. Il détruit divers composés organiques et aromatique. Après contact avec de l'ammoniaque forme le nitrite d'ammonium, détruit des doubles liaisons de carbone.
Être présent dans l'atmosphère à des concentrations élevées, l'ozone se décompose spontanément. Cela libère la chaleur et de la molécule formée O2. Plus la concentration, plus la chaleur de réaction. Lorsque la teneur en ozone est supérieure à 10%, il est accompagné d'une explosion. En augmentant la température et en réduisant la pression ou lors d'un contact avec des matériaux organiques est plus rapide décomposition de l'O3.
Histoire de la découverte
Dans la chimie, l'ozone n'a pas été connu au XVIIIe siècle. Je l'ai découvert était en 1785 en raison de l'odeur, que le physicien Van Marum entendu en utilisant la machine électrostatique. Même 50 ans après que le gaz ne sont pas apparus dans des expériences scientifiques et de la recherche.
Scientifique Kristian Shonbeyn en 1840 a étudié l'oxydation du phosphore blanc. Au cours des expériences, il a pu identifier une substance inconnue, qu'il appelait « ozone ». Chimiste engagé étroitement dans l'étude de ses propriétés, et un procédé de production du gaz nouvellement découvert.
Bientôt matériel de recherche et a rejoint d'autres scientifiques. Le célèbre physicien Nikola Tesla même construit d' abord dans l'histoire du générateur d'ozone. Utilisation industrielle de O3 a commencé à la fin du XIXe siècle, avec l'avènement des premières installations pour l'approvisionnement en eau potable à la maison. La substance utilisée pour la désinfection.

Ozone dans l'atmosphère
Notre Terre est entourée d'une enveloppe invisible de l'air – l'atmosphère. Sans elle la vie sur terre serait impossible. composants extérieurs: l'oxygène, l'ozone, l'azote, l'hydrogène, le méthane et d'autres gaz.
L'ozone par lui-même n'existe pas et il n'y a qu'une suite de réactions chimiques. Près de la surface de la terre, il est formé par la foudre électrique pendant un orage. manière Unnatural il apparaît en raison des émissions des voitures, les usines, les vapeurs d'essence, les installations existantes de centrales thermiques.

ozone au niveau du sol appelé troposphère ou au niveau du sol. Il est stratosphérique. Elle est causée par le rayonnement ultraviolet du soleil. Il est formé à une distance de 19-20 km au-dessus de la surface de la planète et se prolonge jusqu'à une hauteur de 25-30 km.
La couche d'ozone stratosphérique O3 forme une planète, qui le protège de la force du rayonnement solaire. Il absorbe environ 98% du rayonnement ultraviolet ayant une longueur d'onde suffisante pour l'apparition du cancer et des brûlures.
Application de la substance
Ozone – il est un excellent oxydant et destructeur. Cette propriété a été utilisé pour purifier l'eau potable. effet néfaste sur la substance nocive pour les bactéries et les virus humains, et lorsque l'oxydation lui-même converti en oxygène inoffensif.
Il est capable de tuer même résistant aux organismes de chlore. En outre, il est utilisé pour purifier les eaux usées de l'huile nocive pour l'environnement, des sulfures, de phénols, etc. De telles pratiques sont courantes principalement aux États-Unis et certains pays européens.
L'ozone est utilisé en médecine pour la désinfection des instruments dans l'industrie avec l'aide de papier blanchi, huile claire sont des substances différentes. L'utilisation de O3 pour purifier l'air, l'eau et l'espace appelé ozonation.

L'ozone et les
En dépit de toutes ses propriétés bénéfiques, l'ozone peut être dangereux pour les humains. Si le gaz dans l'air sera plus que l'homme peut souffrir, l'empoisonnement ne peut être évité. En russe son taux admissible de 0,1 g / l.
Au-dessus que les règles apparaissent des symptômes typiques d'une intoxication chimique, tels que des maux de tête, une irritation, des étourdissements. L'ozone réduit transmis par la résistance des voies aériennes à l'infection et diminue également la pression artérielle. Lorsque la concentration de gaz au-dessus de 9,8 mg / l est possible oedème pulmonaire et même la mort.
En même temps, reconnaître l'ozone dans l'air assez facilement. Odeur « fraîcheur », chloro ou « cancers » (telle que revendiquée Mendeleev) et à faible teneur nettement audible de substances.












