Électrolytes sont les produits chimiques connus depuis les temps anciens. Cependant, la plupart des domaines de leur application, ils ont gagné récemment. Nous allons discuter de la priorité pour l'industrie l'utilisation de ces substances et nous comprendrons que le passé est le présent, et diffèrent les uns des autres. Mais nous commençons par une digression dans l'histoire.

histoire
Les plus vieux électrolytes connus – sels et acides est ouvert même dans le monde antique. Cependant, la compréhension de la structure et les propriétés des électrolytes ont évolué au fil du temps. Théorie de ces processus ont évolué depuis 1880, quand il a fait un certain nombre de découvertes, les théories liées aux propriétés de l'électrolyte. Il y avait plusieurs sauts quantiques dans les théories décrivant les mécanismes d'interaction des électrolytes avec de l'eau (en fait seulement en solution, ils acquièrent les propriétés qui rendent leur utilisation dans l'industrie).
Maintenant, nous allons voir exactement sont plusieurs théories qui ont eu le plus grand impact sur le développement des concepts d'électrolytes et de leurs propriétés. Commençons par la théorie la plus commune et simple, que chacun d'entre nous ont pris à l'école.
Arrhenius théorie de la dissociation électrolytique
En 1887 , le chimiste suédois Svante Arrhenius et chimiste russe-allemand Wilhelm Ostwald a développé la théorie de la dissociation électrolytique. Cependant, ici aussi, il est pas si simple. Arrhenius lui-même était partisan que l'on appelle la théorie physique des solutions qui ne prennent pas en compte l'interaction des composants de la substance avec de l'eau et a affirmé qu'il ya des particules chargées (ions libres) en solution. Soit dit en passant, de ces positions aujourd'hui envisagent la dissociation électrolytique de l'école.
On parle tout de même qui fait la théorie et la façon dont il explique le mécanisme d'interaction des substances avec de l'eau. Comme pour tout autre travail, il a plusieurs postulats qu'il utilise:
1. Dans la réaction de l'eau avec la substance se décompose en ions (positifs – cations et négative – anions). Ces particules sont soumises à une hydratation ils attirent les molécules d'eau qui, par ailleurs, est chargé d'une part de façon positive et de l'autre – pour former des complexes d'aqua négatif (dipôle formé) (solvates).
2. Le processus de dissociation est réversible – à savoir si la substance est divisée en ions, sous l'influence d'un facteur quelconque, il peut à nouveau devenir une source.
3. Si les électrodes de connexion à la solution et laisser le courant, les cations commenceront à se déplacer vers l'électrode négative – la cathode et les anions à la charge positive – anode. Voilà pourquoi les substances sont facilement solubles dans l'eau, conduisent l'électricité mieux que l'eau elle-même. Pour la même raison, ils sont appelés électrolytes.
4. Le degré de dissociation de l' électrolyte caractérise substance en pourcentage soumise à la dissolution. Ce taux dépend du solvant et les propriétés du soluté, la concentration de ce dernier et la température extérieure.
Ici, en fait, et tous les principes de base de cette théorie simple. Eux nous utiliserons dans cet article pour une description de ce qui se passe dans la solution d'électrolyte. Des exemples de ces composés Examinons un peu plus tard, et laissez-nous maintenant d'envisager une autre théorie.

acides théorie et des bases de Lewis
Selon la théorie de la dissociation électrolytique, l'acide – une substance présente dans une solution dont le cation hydrogène et la base – le composé se décompose en solution à un anion hydroxyde. Il y a une autre théorie, du nom du célèbre chimiste Gilbert Lewis. Il vous permet d'étendre le concept de plusieurs acides et bases. Selon la théorie de Lewis, l'acide – est des ions ou des molécules de substances qui ont des orbitales d'électrons libres et qui sont capables d'accepter un électron d' une autre molécule. Facile à deviner que les bases seront les particules qui sont capables de donner un ou plusieurs de ses électrons à l'acide « utiliser ». Il est intéressant ici est que l'acide ou la base peut être non seulement l'électrolyte, mais aussi toute substance même insoluble dans l'eau.

théorie protolytique Brendsteda Lowry
En 1923, indépendamment l'un de l'autre, deux scientifiques – J. et la théorie de T. Lowry Bronsted, qui est maintenant activement utilisés par les scientifiques pour décrire les processus chimiques. L'essence de cette théorie est que la dissociation du sens se résume à un transfert de protons de la base acide. Ainsi, celle-ci est comprise ici comme un accepteur de protons. Ensuite, l'acide est leur donneur. La théorie explique aussi l'existence de bonnes substances qui présentent des propriétés et des acides et des bases. De tels composés sont appelés amphotère. En théorie Bronsted-Lowry pour leur terme applique également ampholytes, alors que l'acide ou de base communément appelés protolithes.
Nous sommes arrivés à la section suivante. Ici, nous allons vous montrer ce que différents électrolytes forts et faibles, et de discuter de l'impact des facteurs externes sur leurs propriétés. Et puis de procéder à la description de leur application pratique.
électrolytes forts et faibles
Chaque substance réagit avec l'eau seule. Certains se dissolvent bien (par exemple, le chlorure de sodium), et certains ne se dissolvent pas (par exemple, la craie). Ainsi, toutes les substances sont divisées en électrolytes forts et faibles. Ces derniers sont des substances qui interagissent faiblement avec de l'eau et déposées sur le fond de la solution. Cela signifie qu'ils ont un très faible degré de dissociation et les liaisons à haute énergie, ce qui permet à la molécule de se désintégrer en ses ions constitutifs dans des conditions normales. électrolytes faible dissociation se produit lentement ou en augmentant la température et la concentration de la substance en solution.
Tu parles d'un électrolyte solide. Ceux-ci comprennent tous les sels solubles, ainsi que des acides forts et alcalis. Ils sont faciles à décomposer en ions et est très difficile de les recueillir dans les précipitations. Le courant dans l'électrolyte, par ailleurs, est réalisée grâce aux ions contenus dans la solution. Par conséquent, les meilleurs électrolytes forts conducteurs. Des exemples de celui-ci: acides forts, les alcalis, les sels solubles.
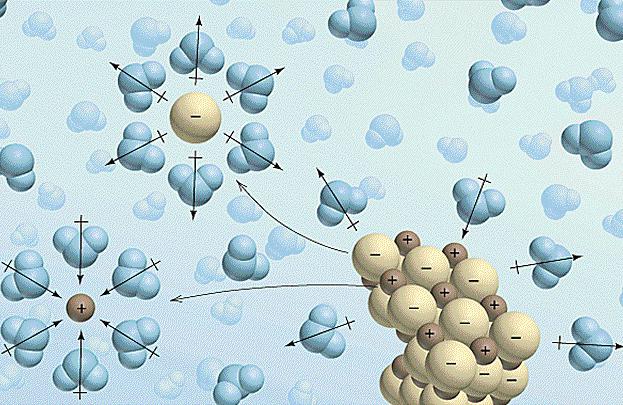
Facteurs influant sur le comportement des électrolytes
Maintenant , regardez la façon dont le changement affecte l'environnement extérieur sur les propriétés des substances. La concentration affecte directement le degré de dissociation de l'électrolyte. De plus, cette relation peut être exprimée mathématiquement. La loi qui décrit cette relation, appelée la loi de dilution d'Ostwald et est écrit: a = (K / c) 1/2. Ici, un – est le degré de dissociation (pris sous forme de fraction), K – constante de dissociation, différent pour chaque substance, et – la concentration en électrolyte dans la solution. Selon cette formule, vous pouvez en apprendre beaucoup sur la matière et son comportement en solution.
Mais nous nous sommes éloignés du sujet. En outre la concentration du degré de dissociation de l'électrolyte affecte également la température. Pour la plupart des substances augmentent, il augmente la solubilité et la réactivité. Cela peut expliquer l'apparition de certaines réactions seulement à température élevée. Dans des conditions normales, ils sont soit très lentement, ou dans les deux sens (ce processus est appelé réversible).
Nous avons examiné les facteurs qui déterminent le comportement d'un système tel qu'une solution d'électrolyte. Nous passons maintenant à l'application pratique de ceux-ci, sans doute, très importantes substances chimiques.
application industrielle
Bien sûr, tout le monde a entendu le mot « électrolyte » appliqué aux batteries. Dans un véhicule à l'aide batteries plomb-acide, l'électrolyte qui joue le rôle d'un acide sulfurique à 40 pour cent. Pour comprendre pourquoi il est tout ce que vous avez besoin est une substance nécessaire pour comprendre les caractéristiques de la batterie.
Alors, quel est le principe de fonctionnement d'une batterie? Dans la réaction réversible qui a lieu la conversion d'une substance dans une autre, à la suite de laquelle les électrons sont libérés. Lorsque l'interaction de charge de la batterie se produit des substances, ce qui est impossible dans des conditions normales. Cela peut être représenté comme l'accumulation du pouvoir dans le matériau à la suite d'une réaction chimique. Lors de la décharge de la transformation inverse commence, ce qui réduit le système dans son état initial. Ces deux processus constituent ensemble un cycle de charge-décharge.
Considérons le procédé ci-dessus est un exemple spécifique – la batterie au plomb-acide. Comme il est facile à deviner, la source de courant est constituée d'un élément, comprenant un conducteur (fil de diokisd et PbO 2) et d' un acide. Toute batterie comprend les électrodes et l'espace entre les remplir avec juste l'électrolyte. Comme ce dernier, comme nous l'avons vu, dans cet exemple utilise la concentration en acide sulfurique de 40 pour cent. La cathode de la batterie à base de dioxyde de plomb, l'anode est en plomb pur. Tout cela est parce que ces deux électrodes différentes réactions se produisent réversibles impliquant des ions qui sont l'acide dissociées:
- PbO 2 + SO 4 2- + 4 H + + 2e – = PbSO 4 + 2H 2 O (la réaction se produisant à l'électrode négative – cathode).
- Pb + SO 4 2- – 2e – = PbSO 4 (la réaction se produisant à l'électrode positive – l'anode).
Si vous avez lu la réaction de gauche à droite – obtenir les processus qui se produisent pendant la décharge de la batterie, et si droit – moyennant un supplément. Chaque source de courant chimique de ces réactions est différente, mais le mécanisme de leur apparition en général décrit les mêmes: il y a deux processus, l' un dont les électrons sont « absorbés » et l'autre, au contraire, « aller ». La chose la plus importante est que le nombre d'électrons absorbés égal au nombre publié.
En fait, en plus des batteries, il existe de nombreuses applications de ces substances. En général, les électrolytes, dont des exemples que nous avons donnés, – il est seulement un grain de la variété de substances qui sont réunies sous ce terme. Ils nous entourent partout, partout. Par exemple, le corps humain. Pensez-vous qu'il n'y a pas de telles substances? Très mal. On les trouve partout en nous et constituent le plus grand nombre d'électrolytes sanguins. Ceux-ci comprennent, par exemple, des ions de fer, qui font partie de l'hémoglobine et aide à transporter l'oxygène vers les tissus de notre corps. électrolytes sanguins jouent également un rôle clé dans la régulation de l'équilibre eau-sel et le travail du cœur. Cette fonction est assurée par les ions potassium et sodium (il y a même un processus qui se produit dans des cellules qui sont nommés pompe potassium-sodium).
Toute substance que vous êtes capable de dissoudre au moins un peu – électrolytes. Et il n'y a pas d'industrie et de nos vies, peu importe où ils sont appliqués. Il est non seulement les batteries dans les voitures et les batteries. Est-tout traitement chimique et alimentaire, les usines militaires, les usines de vêtements et ainsi de suite.
La composition de l'électrolyte, en passant, est différent. Ainsi, il est possible d'affecter l'électrolyte acide et alcalin. Ils diffèrent fondamentalement dans leurs propriétés: comme nous l'avons dit, les acides sont donneurs de protons et alcalins – accepteurs. Mais au fil du temps, les changements dans la composition d'électrolyte en raison de la perte d'une partie de la concentration de la substance soit diminue ou augmente (tout dépend de ce qui est perdu, l'eau ou de l'électrolyte).
Chaque jour, nous sommes confrontés à eux, mais très peu de gens savent exactement la définition d'un terme comme électrolytes. Des exemples de substances spécifiques dont nous avons parlé, donc nous allons passer à un peu des concepts plus complexes.

Les propriétés physiques des électrolytes
Maintenant sur la physique. La chose la plus importante à comprendre dans l'étude de ce sujet – est passé en cours aux électrolytes. rôle décisif dans ce joué par les ions. Ces particules chargées peuvent migrer d'une partie de la solution de charge à l'autre. Ainsi, les anions ont toujours tendance à l'électrode positive et des cations – à la borne négative. Ainsi, en agissant sur la solution courant électrique, on divise les charges sur les côtés opposés du système.
caractéristiques physiques très intéressantes telles que la densité. Elle affecte de nombreuses propriétés de nos composés en discussion. Et saute souvent la question: « Comment augmenter la densité de l'électrolyte » En fait, la réponse est simple: il est nécessaire d'abaisser la teneur en eau de la solution. Etant donné que la densité de l'électrolyte principalement déterminé la densité de l'acide sulfurique, elle dépend largement de la concentration finale. Il y a deux façons de mettre en œuvre le plan. Le premier est assez simple: faire bouillir l'électrolyte contenu dans la batterie. Pour ce faire, vous devez le charger de telle sorte que la température intérieure a légèrement dépassé une centaine de degrés Celsius. Si cette méthode ne fonctionne pas, ne vous inquiétez pas, il y a un autre: il suffit de remplacer l'ancien nouvel électrolyte. Pour ce faire, vider l'ancienne solution pour nettoyer l'intérieur de l'acide sulfurique résiduel dans l'eau distillée, puis verser une nouvelle partie. En règle générale, la qualité des solutions d'électrolyte ont immédiatement une valeur de concentration souhaitée. Après le remplacement peut oublier comment augmenter la densité de l'électrolyte.
Composition d'électrolyte détermine en grande partie ses propriétés. Des caractéristiques telles que la conductivité électrique et la densité, par exemple, dépendent fortement de la nature du soluté et sa concentration. Il y a une autre question de la quantité de l'électrolyte dans la batterie peut être. En fait, son volume est directement lié à la capacité déclarée du produit. Le plus de l'acide sulfurique à l'intérieur de la batterie, de sorte qu'il est plus puissant, t. E. Plus la tension est capable de produire.

Où est-il utile?
Si vous êtes un passionné de voiture ou tout simplement intéressé par les voitures, vous comprendrez tout vous. Certes, vous savez même comment déterminer la quantité de l'électrolyte dans la batterie est maintenant. Et si vous êtes loin de la voiture, puis la connaissance des propriétés de ces substances, leur utilisation et la façon dont ils interagissent les uns avec les autres ne sera pas superflu. Sachant cela, vous n'êtes pas confus, on vous demande de dire ce que l'électrolyte dans la batterie. Bien que même si vous n'êtes pas un passionné de voiture, mais vous avez une voiture, puis la connaissance du dispositif de batterie sera absolument pas de mal et vous aidera à réparer. Il sera beaucoup plus facile et moins cher de tout faire vous-même, que d'aller au centre de la voiture.
Et pour en savoir plus sur ce sujet, nous vous recommandons de vérifier le manuel de chimie pour les écoles et les universités. Si vous connaissez bien cette science et de lire des livres assez, la meilleure option sera « sources de courant chimiques » Varypaeva. Il sont exposés en détail toute la théorie de la vie de la batterie, une variété de batteries et éléments d'hydrogène.
conclusion
Nous sommes arrivés à une fin. Résumons. Au-dessus, nous avons discuté de tout, comme pas une telle chose comme électrolytes: exemples, théorie de la structure et les propriétés, fonctions et applications. Encore une fois, il faut dire que ces composés font partie de notre vie, sans laquelle il ne pourrait pas exister, notre corps et tous les domaines de l'industrie. Vous vous souvenez des électrolytes du sang? Merci à eux, nous vivons. Et nos voitures? Avec cette connaissance, nous pouvons résoudre tout problème avec la batterie, comme maintenant comprendre comment augmenter la densité de l'électrolyte en elle.
Tout impossible de dire, mais nous ne fixe pas un tel objectif. Après tout, ce n'est pas tout ce qui peut être dit au sujet de ces substances étonnantes.







