méthane de formule moléculaire et structurelle
Formule moléculaire, structurale et électronique de méthane sont basés sur la théorie de la structure des composés organiques Butlerov. Avant d'écrire ces formules, nous commençons par une brève caractérisation de l'hydrocarbure.

Caractéristiques de méthane
Cette substance est un explosif, il est aussi appelé gaz « marais ». L'odeur spécifique des hydrocarbures limitatifs connus de tous. Le processus de combustion de celui-ci reste des composants chimiques nocifs pour le corps humain. Ce méthane est un participant actif dans la formation de l'effet de serre.
propriétés physiques
Le premier représentant de la série des alcanes homologues a été découvert par des scientifiques dans l'atmosphère de Titan et Mars. Compte tenu du fait que le méthane est lié à l'existence d'organismes vivants sont apparus hypothèse de l'existence de la vie sur ces planètes. Sur Saturne, Jupiter, Neptune, Uranus, produit du méthane est apparu que le traitement chimique des substances d'origine minérale. Sur la surface de notre planète de sa faible teneur.
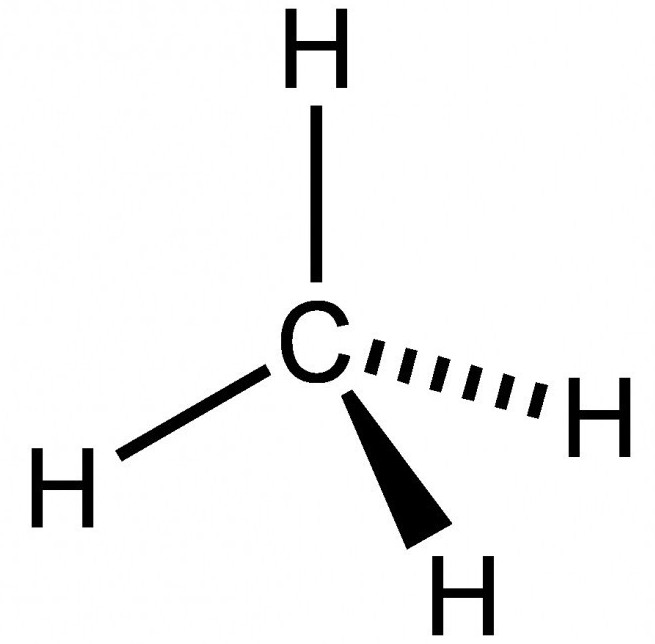
caractéristiques générales
Le méthane n'a pas de couleur, il est plus léger que l'air presque deux fois, est peu soluble dans l'eau. La composition du gaz naturel montant atteint 98 pour cent. Le gaz passant à l'huile contient de 30 à 90 pour cent du méthane. En plus de méthane est d'origine biologique.
Ongulés herbivores chèvres et vaches émettent le traitement dans les estomacs des bactéries quantité assez importante de méthane. Parmi les sources importantes de la série homologue d'alcanes marécageuses sélectionner, termites, filtrage photosynthèse des plantes de gaz naturel. A la détection de traces de méthane sur la planète, nous pouvons parler de l'existence de sa vie biologique.

Méthodes de préparation
La formule structurale détaillée du méthane est la preuve que, dans sa molécule uniquement des simples liaisons saturées formées nuages hybrides. Des modes de réalisation supplémentaires de préparation en laboratoire de la note d'hydrocarbure d' alliage avec de l' acétate de sodium solide avec un alcali, et l'interaction de carbure d'aluminium avec de l' eau.
flamme bleuâtre méthane solide, tout en soulignant l'ordre de 39 MJ par mètre cube. Mélange explosif forme la substance à l'air. Le méthane la plus dangereuse, qui est libéré lors de l'exploitation souterraine des gisements minéraux dans les mines de montagne. Risque élevé d'explosion des plantes de méthane et la valorisation du charbon et briquetage, ainsi que les industries de tri.
effet physiologique
Si le pourcentage de méthane dans l'air est de 5 à 16 pour cent, en contact avec de l'oxygène peuvent être mis à feu du méthane. Dans le cas d'une augmentation significative dans le mélange du produit chimique augmente la probabilité d'explosion.
Si la concentration de l'air de l'alcane est de 43 pour cent, il est l'étouffement de cause.
Avec la vitesse de propagation de l'explosion de 500 à 700 mètres par seconde. Une fois que le méthane est mis en contact avec une source de chaleur, processus d'allumage alcane se produit avec un certain retard.
Il était sur cette propriété production basée d'équipements électriques antidéflagrants et la sécurité des composants explosifs.
Etant donné que le méthane est l'hydrocarbure saturé plus stable à la chaleur, il est largement utilisé comme combustible industriel et domestique et est également utilisé comme matière première précieuse pour la synthèse chimique. La formule développée du méthane-éthyl-tri caractérise les caractéristiques de structure des membres de cette classe d'hydrocarbures.
Dans le procédé de réaction chimique avec le chlore par exposition à un rayonnement ultraviolet peut être formé de plusieurs produits de réaction. En fonction de la quantité de matière de départ peut être dans la substitution recevoir le chlorométhane, le chloroforme, le tétrachlorure de carbone.
Dans le cas d'une combustion incomplète de la suie formée de méthane. Le formaldéhyde est formé dans le cas de l'oxydation catalytique. Le produit final de la réaction est du disulfure de carbone avec du soufre.

Structure du méthane Propriétés
Quelle est sa formule structurelle? Le méthane se réfère à des hydrocarbures saturés répondant à la formule générale C n H 2n + 2. Considérons une formation de molécule particulière pour expliquer la façon dont la formule structurale est formée.
Le méthane est composé d'un atome de carbone et quatre atomes d'hydrogène liés entre eux par moment dipolaire d'une liaison covalente. Nous expliquons la structure sur la base des formules structurales atomes de carbone.
Voir l'hybridation
La structure spatiale du méthane, caractérisé par la structure tétraédrique. Depuis l'extérieur au niveau du carbone quatre électrons de valence, la transition se produit d'électrons sur l'atome de chauffage avec un second s-orbitales p. Par conséquent, le dernier niveau de puissance au niveau du carbone situé quatre apparié ( « libre ») de l'électron. formule structurale complète du méthane est basée sur le fait que la formation des quatre nuages hybrides qui sont orientés dans l'espace à un angle de 109 degrés 28 minutes, la formation d'une structure de tétraèdre. En outre il y a chevauchement des sommets des nuages hybrides avec des nuages non hybrides des atomes d'hydrogène.
formule structurale complète et de méthane condensé répond pleinement théorie Butlerova. Entre les formes de carbone et d'hydrogène simple liaison (simple), de sorte que les réactions chimiques ne sont pas connexion typique.
Ci-dessous la formule de structure ultime. Le méthane – est le premier représentant de la classe d'hydrocarbures saturés, il a des propriétés typiques limitent alcane. Formule développée E et de méthane confirment le type d'hybridation de l'atome de carbone dans la matière organique.

Depuis le cours de chimie de l'école
Cette classe d'hydrocarbures, représentatif est un « gaz des marais », étudié au cours de 10 classe de lycée. Par exemple, les enfants ont proposé la tâche suivante caractère: « écrire des formules structurelles de méthane ». Il faut comprendre que seule une configuration détaillée de la structure de cette substance peut être peint sur la théorie Butlerova.
Sa formule abrégée sera le même que le moléculaire, écrit sous la forme de CH4. En vertu des nouvelles normes fédérales d'éducation qui sont imposées dans le cadre de la réorganisation de l'enseignement russe au cours de la chimie de base toutes les questions relatives aux caractéristiques des classes de substances organiques, comprennent la surveillance.
synthèse industrielle
procédés industriels à base de méthane comme une importante composante chimique ont été développés comme l'acétylène. La base de craquage thermique ou électrique est précisément sa formule structurale. Le méthane dans l'oxydation catalytique de l'ammoniac pour former de l'acide cyanhydrique.
Appliquer cette matière organique pour la production de gaz de synthèse. Par réaction avec de la vapeur, un mélange de monoxyde de carbone et d' hydrogène, qui sont des matières premières pour la limite de production de mono – alcools, des composés carbonyle.
Il est particulièrement important de la réaction avec l'acide nitrique, ce qui nitrométhane.

L'utilisation comme carburant
En raison du manque de sources naturelles d'hydrocarbures, ainsi que l'appauvrissement de la base des ressources, en particulier question pertinente liée à la recherche de nouvelles sources (alternatives) pour le carburant. Une telle option est le biodiesel, qui y inclus et le méthane.
Compte tenu de la différence de densité entre le carburant de l'essence et le premier membre de la classe des alcanes, il existe certaines caractéristiques dans son application en tant que source d'énergie pour les moteurs d'automobiles. Afin d'éviter la nécessité de porter une grande quantité de méthane, par compression pour augmenter sa densité (sous une pression d'environ 250 atmosphères). Le méthane stocké dans l'état liquéfié dans des cylindres installés dans le véhicule.
L'exposition à l'atmosphère
Nous avons déjà discuté du fait que le méthane a un impact sur l'effet de serre. Si le degré de l'action de monoxyde de carbone (4) sur le climat traditionnellement considéré comme l'unité, puis fraction « gaz des marais » est de 23 unités. Au cours des deux derniers siècles, les scientifiques ont observé une augmentation de la teneur quantitative du méthane dans l'atmosphère de la Terre.
À l' heure actuelle, le montant approximatif de CH4 est estimé à 1,8 parties par million. Malgré le fait que ce chiffre est 200 fois inférieure à la présence de dioxyde de carbone, il y a une conversation entre les scientifiques sur le risque possible de piéger la chaleur émise par la planète.
En raison de l'excellent « gaz des marais » pouvoir calorifique est utilisé non seulement comme matière première dans la réalisation de la synthèse chimique, mais aussi comme une source d'énergie.
Par exemple, le méthane exploiter une variété de chaudières à gaz, colonnes, conçus pour les systèmes de chauffage individuels dans des maisons privées et chalets.
Une telle option d'auto-chauffage est très bénéfique pour les propriétaires, ne sont pas liés à l'accident, en prenant systématiquement dans les systèmes de chauffage centralisé. chaudière à gaz en raison de fonctionnement sur un type de carburant donné, il suffit de 15-20 minutes pour chauffer entièrement la maison de deux étages.

conclusion
Le méthane, les formules structurelles et moléculaires qui ont été données ci-dessus, une source d'énergie naturelle. En raison du fait qu 'il comporte uniquement des atomes de carbone et d'hydrogène, les écologistes reconnaissent la sécurité de l'environnement de l'hydrocarbure saturé.
Dans des conditions standard (température de l'air de 20 degrés Celsius et une pression de 101325 Pa) la substance est gazeuse, non toxique, insoluble dans l'eau.
Dans le cas où la température de l'air est abaissée à -161 degrés, il est le méthane comprimé qui est largement utilisé dans l'industrie.
Le méthane a un impact sur la santé humaine. Il n'est pas une substance toxique, mais il est un gaz suffocant. Il y a des limites même (MAC) sur la teneur en substances chimiques dans l'atmosphère.
Par exemple, le travail dans les mines ne sont autorisées que dans les cas où le montant ne dépasse pas le mètre cube à 300 milligrammes. L'analyse des caractéristiques d'une structure de la matière organique possible de conclure que les similitudes dans les propriétés chimiques et physiques avec tous les autres membres de la classe des hydrocarbures saturés (limite).
Nous avons analysé la formule structurelle, la structure spatiale du méthane. série homologue qui commence par « gaz des marais » a la formule moléculaire générale C n H 2n + 2.












