Les alcanes, les alcènes, les alcynes – est des produits chimiques organiques. Ils sont tous construits de tels éléments chimiques tels que le carbone et l'hydrogène. Les alcanes, les alcènes, les alcynes – sont des composés chimiques, qui appartiennent au groupe des hydrocarbures.
Dans cet article, nous examinerons alcynes.
Qu'est-ce?
Ces substances sont également appelées hydrocarbures d'acétylène. La structure de l'alcyne fournit la présence dans leurs molécules d'atomes d'hydrogène et de carbone. General formule acétyléniques hydrocarbures comme: C n H 2n-2. Simple alcyne simple – éthyne (acétylène). Il a ici une formule chimique – C 2 H 2. se réfère aussi à des alcynes de formule propyne C 3 N 4. En outre, pour les hydrocarbures acétyléniques peuvent comprendre butyne (C 4 H 6), Pentin (C 5 H 8) hexyne (C 6 H 10) heptyn (C 7 H 12), octyne (C 8 H 14), nonyne ( C 9 H 16) décyne (C 10 H 18), et ainsi de suite. d. Tous les types d'alcynes présentent des caractéristiques similaires. Nous allons les examiner en détail. 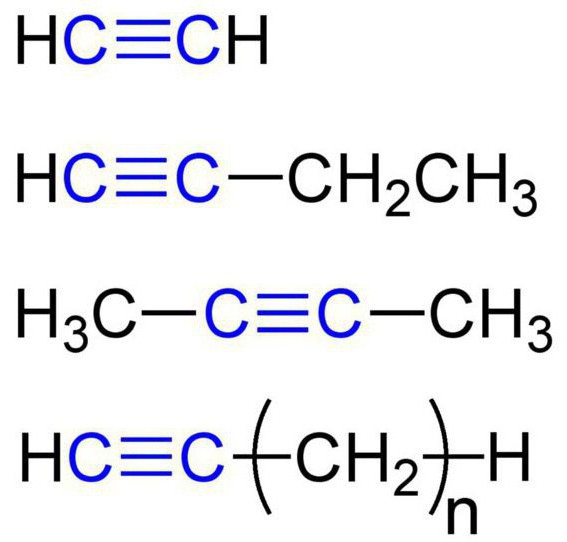
Les propriétés physiques des alcynes
Les caractéristiques physiques des hydrocarbures acétyléniques rappellent alcènes.
Dans des conditions normales, les alcynes, des molécules qui contiennent de deux à quatre atomes de carbone, ont un état d'agrégat gazeux. Ces molécules, qui est de cinq à 16 atomes de carbone, dans des conditions normales de liquide. Ceux dont les molécules 17 ou plusieurs atomes d'un élément chimique, – de matières solides.
Alcynes fondre et bouillir à une température plus élevée que les alcanes et alcènes.
Solubilité dans l'eau est insignifiante, mais légèrement supérieur à celui des alcènes et alcanes.
Solubilité dans les solvants organiques est élevée.
Le alcyne le plus largement utilisé – l'acétylène – a des propriétés physiques:
- Il n'a pas de couleur;
- sans odeur;
- dans des conditions normales, il est à l'état gazeux de l'agrégation;
- Il a une densité inférieure à celle de l'air;
- point d'ébullition – moins 83,6 degrés Celsius;
Les propriétés chimiques des alcynes
Dans ces substances, les atomes sont liés triple liaison, ce qui explique leurs propriétés de base. Alcynes réagissent ce type:
- hydrogénation;
- gidrogalogenirovanie;
- halogénation;
- hydratation;
- la combustion.
Prenons-les dans l'ordre. 
hydrogénation
Les propriétés chimiques des alcynes leur permettent de se livrer à ce type de réaction. Ce type d'interactions chimiques, dans lequel la molécule de substance se fixe à des atomes d'hydrogène supplémentaires. Voici un exemple d'une telle réaction chimique dans le cas de propyne:
2H 2 + C 3 H 4 = C 3 H 8
Cette réaction se produit en deux étapes. Dans la première molécule d'attache propyne deux atomes d'hydrogène, et la seconde – la même quantité.
halogénation
Ceci est une autre réaction, qui fait partie des propriétés chimiques des alcynes. Son résultat acétylénique molécule d'hydrocarbure attache atomes d'halogène. Ces derniers comprennent des éléments tels que chloro, bromo, iodo, etc.
Voici un exemple d'une telle réaction dans le cas d'éthinyl:
C 2 H 2 + 2SІ 2 = C 2 H 2 s² 4
Le même procédé est également possible avec d'autres hydrocarbures acétyléniques.
Gidrogalogenirovanie
Il est également l'une des principales réactions, qui fait partie des propriétés chimiques des alcynes. Elle réside dans le fait que la substance est amenée à réagir avec des composés tels que NSІ, ni, HBr, et d'autres. Cette réaction chimique se produit en deux étapes. Regardons la réaction de ce type sur l'exemple de l'éthinylestradiol:
C 2 H 2 + NSІ = C 2 H 3 s²
C 2 H 2 + s² NSІ = C 2 H 4 s² 2 
hydration
Ceci est une réaction chimique qui est en contact avec l'eau. Il se produit également en deux étapes. Regardons sur l'exemple de l'éthinylestradiol:
H 2 O + H 2 C 2 = C 2 H 3 OH
Une substance qui est formée après la première étape de réaction appelé alcool vinylique.
En raison du fait que, conformément à la règle Eltekova groupe fonctionnel OH ne peut pas être adjacente à la double liaison, le réarrangement des atomes, à la suite de laquelle l'alcool vinylique est formé à l'acétaldéhyde.
Le processus de réaction d'hydratation aussi appelé alcyne Kucherova. 
incendie
Ce processus d'interaction de alcynes avec de l'oxygène à haute température. Tenez compte des substances brûlantes de ce groupe avec l'acétylène par exemple:
2C 2 H 2 + 2O 2 = 2H 2 O + CO 2 + 3C
Quand un excès d'oxygène, d'acétylène et d'autres alcynes brûlent sans formation de carbone. Ainsi alloué que le monoxyde de carbone et de l'eau. Voici l'équation de cette réaction avec par exemple propyne:
4O 2 + C 3 H 4 = 2H 2 O + 2 3SO
La combustion d'autres hydrocarbures acétyléniques se produit également de manière similaire. En conséquence, l'eau est libérée et le dioxyde de carbone.
d'autres réactions
Aussi acétylènes sont capables de réagir avec les sels de métaux tels que l'argent, le cuivre et le calcium. Ainsi, il existe une substitution d'atomes métalliques d'hydrogène. Considérez cet exemple, compte tenu de la réaction avec du nitrate d'acétylène et d'argent:
C 2 H 2 + 2AgNO3 = Ag 2 C 2 + 2NH 4 NO 3 + 2H 2 O
Un autre processus intéressant impliquant alcynes – réaction Zelinsky. Cette formation de benzène à partir d'acétylène quand il est chauffé à 600 ° C en présence de charbon actif. peut être exprimé l'équation de cette réaction comme suit:
3C 2 H 2 = C 6 H 6
polymérisation d'alcynes que possible – le processus d'association de plusieurs molécules de la substance dans un polymère. 
réception
réaction alcyne que nous avons discuté ci-dessus, sont préparés dans le laboratoire de plusieurs façons.
Le premier – un déshydrohalogénation. Il semble équation de réaction ainsi:
C 2 H 4 Br 2 + 2KOH = C 2 H 2 + 2H 2 O + 2KBr
Pour la réalisation de ce procédé consiste à chauffer les réactifs, et ajouter de l'éthanol comme catalyseur.
Il y a également la possibilité d'alcynes à partir de composés inorganiques. Voici un exemple:
CaC 2 + H 2 O = C 2 H 2 + 2CA (OH) 2
La méthode suivante de la production alcyne – déshydrogénation. Voici un exemple d'une telle réaction:
= 3H 2 CH 4 + 2 C 2 H 2
Avec ce type de réaction peut être obtenu non seulement éthyne, mais d'autres hydrocarbures acétyléniques.

L'utilisation de alcyne
Le plus largement utilisé dans l'industrie est le plus simple alcyne – éthyne. Il est largement utilisé dans l'industrie chimique.
- Nécessaire d' acétylène ou d' autres alcynes pour la production d' un autres composés organiques tels que des cétones, des aldéhydes, et d' autres solvants.
- Aussi à partir des alcynes peuvent être obtenus substances qui sont utilisées dans la fabrication des caoutchoucs, le chlorure de polyvinyle et d'autres.
- De propyne peuvent être obtenus à la suite de l'acétone RAKTs Kucherova.
- De plus, l' acétylène est utilisé dans la préparation de produits chimiques tels que l' acide acétique, des hydrocarbures aromatiques, de l' alcool éthylique.
- Plus d'acétylène est utilisé comme combustible avec une chaleur très élevée de combustion.
- En outre réaction de combustion éthynyle est utilisé pour le soudage des métaux.
- De plus, en utilisant un acétylène peut être préparé carbone technique.
- En outre, cette substance est utilisée dans les appareils autonomes.
- L' acétylène et d' autres hydrocarbures nombre de ce groupe sont utilisés comme propulseurs en raison de sa forte chaleur de combustion.
Dans cette alcynes d'application se termine. 
conclusion
Comme la dernière partie de la table est un résumé des propriétés des hydrocarbures d'acétylène et leur préparation.
| Nom réactions | explications | exemple équation |
| halogénation | Réaction d'addition d'une molécule des atomes d'halogènes d'hydrocarbures acétyléniques (brome, iode, chlore, etc.). | C 4 H 6 + 2I 2 = C 6 H 4 I 2 |
| hydrogénation | réaction d'addition d'un atome d'hydrogène molécule alcyne. Il se produit en deux étapes. |
C 3 H 4 + H 2 = C 3 H 6 C 3 H 6 + H 2 = C 3 H 8 |
| Gidrogalogenirovanie | Réaction d'addition de la molécule d'hydrocarbure gidrogalogenov acétylène (ni, NSІ, HBr). Il se produit en deux étapes. |
C 2 H 2 + ni = C 2 H 3 I C 2 H 3 + ni de I = C 2 H 4 I 2 |
| hydration | Les réactions, qui est basée sur l'interaction avec l'eau. Il se produit en deux étapes. |
C 2 H 2 + H 2 O = C 2 H 3 OH C 2 H 3 OH = CH 3 -CHO |
| L'oxydation complète (combustion) | Atsetilenovgo réaction d'hydrocarbures avec de l'oxygène à une température élevée. Ce produit du monoxyde de carbone et de l'eau. |
2C 2 H 5 + 2 = 5O 2H 2 O + 4CO 2 2C 2 H 2 + 2O 2 = H 2 O + CO 2 + 3C |
| Réactions avec des sels de métaux | Elle consiste dans le fait que les atomes de métal sont substitués par des atomes dans les molécules d'hydrocarbures à l'hydrogène acétylénique. |
C 2 H 2 + AgNO3 = C 2 Ag 2 + 2NH 4 NO 3 + 2H 2 O |
Obtenez alcynes peuvent être en laboratoire en utilisant trois méthodes:
- des composés inorganiques;
- par déshydrogénation de composés organiques;
- Procédé de déshydrohalogénation de substances organiques.
Nous avons donc examiné toutes les caractéristiques physiques et chimiques de l'alcyne, leurs méthodes de préparation, des applications dans l'industrie.











