La formule générale pour les alcènes. Propriétés et caractérisation des alcènes
Les composés organiques plus simples comprennent des hydrocarbures saturés et insaturés. Ceux – ci comprennent des substances d'alcanes classe, alcynes, alcènes. 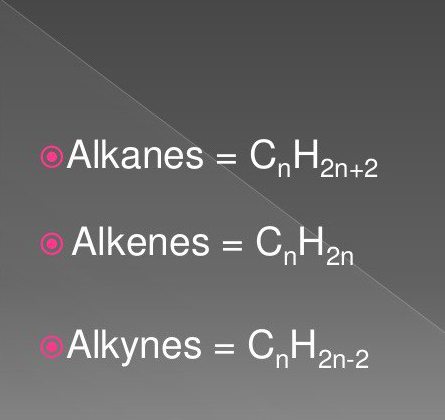
La formule qui comprennent des atomes d'hydrogène et de carbone dans une séquence spécifique et la quantité. Ils sont souvent trouvés dans la nature.
Détermination des alcènes
D'autres leur nom – ou des oléfines hydrocarbures éthylène. Elle est appelée classe de composés actifs dans le 18ème siècle lors de l'ouverture liquide huileux – le chlorure d'éthylène.
Par alcènes sont des substances composées d'éléments de carbone et d'hydrogène. Ils appartiennent aux hydrocarbures acycliques. Ces molécules sont présentes seulement à double liaison (insaturé) reliant les deux atomes de carbone les uns aux autres.
formule alcènes
Chaque classe de composés a une désignation chimique. Les symboles sont des éléments du système périodique indiqué la composition et la structure de la connexion de chaque substance. 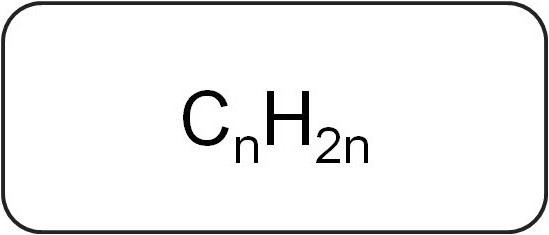
La formule générale des alcènes désignés comme suit: C n H 2n, où le nombre n est supérieur ou égal à 2. Si le déchiffrement , on peut voir que chaque atome de carbone a deux atomes d'hydrogène.
Formule moléculaire alcènes de la série homologue représenté par les structures suivantes: C 2 H 4, C 3 H 6, C 4 H 8, C 5 H 10, C 6 H 12, C 7 H 14, C 8 H 16, C 9 H 18, C 10 H 20. On peut voir que chaque hydrocarbure successive contient une plus de carbone au plus 2 et de l'hydrogène.
Il y a un symbole graphique de l'emplacement et de l'ordre de composés chimiques entre les atomes dans la molécule, qui présente la formule structurelle d'alcènes. Avec l'aide de valence indiquée par le carbone et l'hydrogène.
formule structurelle alcènes peut être affichée sous forme expansée, lorsque représenté, tous les éléments chimiques et les connexions. Une expression plus concise ne soit pas représenté composé de carbone des oléfines et de l'hydrogène au moyen de valence.
Formule désignée du squelette la structure la plus simple. ligne brisée représente le fondement de la molécule dans lesquels les atomes de carbone sont présentées avec ses sommets et les extrémités, et des liens de point d'hydrogène.
Comment former le nom d'oléfines
Sur la base de la nomenclature systématique, la formule et les noms des alcènes à partir alcanes constituent la structure relative aux hydrocarbures saturés. Pour ce faire, au nom du dernier suffixe -ân remplacé par -ilen ou -FR. Un exemple est la formation de butane-butylène et de pentène de pentane.
Pour indiquer la position relative à la double liaison d'atomes de carbone indiqués en chiffres arabes à la fin du nom.
Au coeur des noms des alcènes est la désignation de l'hydrocarbure avec la plus longue chaîne dans laquelle la double liaison est présente. Pendant le démarrage de la chaîne de numérotation est typiquement choisi extrémité qui est la plus proche du composé insaturé, atomes de carbone.
Si la formule structurelle des alcènes a des branches qui indiquent le nom et le numéro de radicaux, et pour leur donner les chiffres correspondant à la position chaîne de carbone. Suivi du nom de l'hydrocarbure. Une fois que les chiffres sont généralement mis un trait d'union.
Là des rejetons radicaux insaturés. Leurs noms peuvent être trivial ou formé par les règles de la nomenclature systématique.
Par exemple, NSC = CH- appelé éthényle ou vinyle.
isomères
Formule moléculaire alcènes ne peuvent pas indiquer l'isomérie. Cependant, pour cette classe de substances, à l'exception de la molécule d'éthylène variation spatiale inhérente. 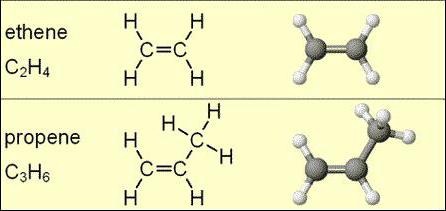
Isomères hydrocarbures éthyléniques peuvent être sur le squelette carboné, de interclasse de position de communication insaturés ou spatiale.
La formule générale des alcènes détermine la quantité d'atomes de carbone et d'hydrogène dans la chaîne, mais ne montre pas la présence et l'emplacement dans celle-ci d'une double liaison. Un exemple est le cyclopropane comme une classe transversale Isomère C 3 H 6 (propylène). D' autres types d'isomérie, sont présentés à C 4 H 8 ou butène.
Divers état de communication insaturé se produit dans le butène-1 ou le butène-2, dans le premier cas, une double liaison est à proximité du premier atome de carbone, et dans le second – au milieu de la chaîne. Isomères de squelette carboné peut être considéré par exemple méthylpropène (CH 3 -C (CH 3) = CH 2) et d' isobutylène ((CH3) 2C = CH 2).
La variation spatiale inhérente du butène-2 et de la position cis-trans. Dans le premier cas, les groupes latéraux sont situés au-dessus et en dessous de la chaîne principale de carbone avec une double liaison dans les seconds substituants isomères sont sur le même côté.
Caractéristiques des oléfines
La formule générale pour alcènes détermine la condition physique de tous les membres de cette classe. Commençant et finissant par butylène d'éthylène (C 2 à C 4), les substances existent sous une forme gazeuse. Donc, l'éthène incolore a une odeur sucrée, une faible solubilité dans l'eau, de poids moléculaire inférieur à celui de l'air.
Sous forme liquide, présente des hydrocarbures période homologue de C 5 à C 17. A partir de l'alcène ayant dans la chaîne principale de 18 atomes de carbone, une transition de l'état physique sous une forme solide.
Tous les oléfines de rang faible solubilité dans les milieux aqueux, mais bien dans la nature organique de solvant, tel que le benzène ou l'essence. Leur poids moléculaire est inférieur à celui de l'eau. Augmenter les fils de chaîne de carbone à une augmentation des caractéristiques de température par des points de fusion et d'ébullition de ces composés.
propriétés oléfines
Formule développée alcènes montre la présence d'une double liaison dans le squelette et de σ- en n deux atomes de carbone de liaison. Cette structure de la molécule détermine ses propriétés chimiques. Communication-π est considéré comme pas très forte, ce qui permet de détruire avec la formation de deux nouvelles obligations σ, qui sont obtenus à la suite de se joindre à une paire d'atomes. Les hydrocarbures insaturés sont des donneurs d'électrons. Ils prennent part aux processus de connexion de type électrophile. 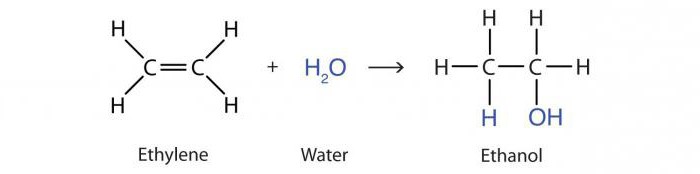
Une propriété chimique importante des alcènes est un procédé d'halogénation avec la libération de composés tels les substances de digalogenoproizvodnym. Les atomes d'halogène peuvent être attachés au composé par des doubles atomes de carbone. Un exemple est la bromation du propylene pour former le 1,2-dibromopropane:
H 2 C = CH-CH 3 + Br 2 → BrCH 2 -CHBr-CH 3.
Ce couleurs de processus de neutralisation dans l' eau de brome alcènes considérés comme des preuves qualitatives de la présence de double liaison.
réactions importantes olifinov se rapporte l'hydrogénation avec addition de molécules d'hydrogène sous l'action de métaux catalytiques tels que le platine, le palladium ou le nickel. Cela se traduit par des hydrocarbures avec une liaison saturée. alcanes de formule, les alcènes sont donnés ci-dessous dans l'hydrogénation du butène:
CH 3 -CH 2 -CH = CH 2 + H 2 → CH 3 Ni -CH 2 -CH 2 -CH 3.
Le processus d'adhésion des molécules d'halogénure appelées oléfines
gidrogalogenirovaniem passant par la règle, ouverte Markovnikov. Un exemple est l'hydrobromation de propylene pour former le 2-bromopropane. Il est relié à la double liaison hydrogène-carbone, qui est considéré comme le plus hydrogéné:
CH 3 -CH = CH 2 + HBr → CH 3 -BrCH-CH 3.
réaction d'addition de l'eau alcènes avec des acides est connue sous hydratation. Le résultat est une molécule de l'alcool 2-propanol :
CH 3 -HC = CH 2 + H 2 O → CH 3 -OHCH-CH 3.
Lorsqu'ils sont exposés à des alcènes procédé de sulfonation de l'acide sulfurique se produit:
CH 3 -HC = CH 2 + HO-OSO-OH → CH 3 -CH 3 CH-OSO 2 -OH.
La réaction se déroule avec formation d'esters d'acides, par exemple l'acide izopropilsernoy.
Alcènes sensibles à l'oxydation au cours de leur combustion sous l'action de l'oxygène pour former de l'eau et du dioxyde de carbone:
2CH 3 -HC = CH 2 + 2 → 9O 6CO 2 + 6H 2 O.
La réaction des composés oléfiniques et un permanganate de potassium dilué dans une solution donne lieu à une structure glycols ou des alcools dihydriques. Cette réaction est également oxydante pour former l'éthylène glycol et solution de blanchiment:
3H 2 C = CH 2 + 4H 2 O + 2KMnO 4 → 3OHCH-CHOH + 2 + 2MnO 2KOH.
molécule d'alcène peut être impliquée dans la polymérisation par un mécanisme radicalaire ou anionique cationique libre. Dans le premier cas, sous l'influence de peroxydes obtenus polymère de type polyéthylène.
Selon le second catalyseurs cationiques mécanisme sont les agents acides et anioniques sont un polymère organométallique avec allocation stereoselective.
Qu'est-ce que alcanes
Ils sont appelés paraffines ou de limiter les hydrocarbures acycliques. Ils ont une structure linéaire ou ramifiée, qui ne contient que des liaisons simples saturés. Tous les membres de la série homologue de cette classe répondent à la formule générale C n H 2n + 2. 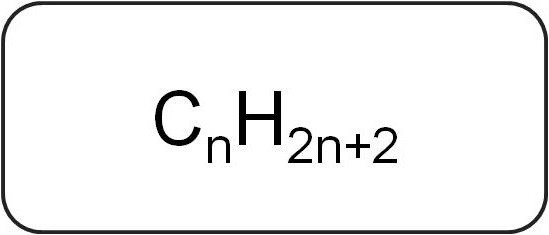
Dans leur structure ne contient que des atomes de carbone et d'hydrogène. La formule générale de la notation formée alcène hydrocarbures saturés.
Les noms des alcanes et leurs caractéristiques
Le représentant le plus simple de cette classe est le méthane. Suivi par des substances telles que l'éthane, le propane et le butane. La base de leur nom est la racine du chiffre dans la langue grecque, à laquelle est ajouté le suffixe -an. Les noms sont répertoriés dans Alcanes la nomenclature IUPAC.
La formule générale pour les alcènes, les alcynes, les alcanes ne comprend que deux espèces d'atomes. Ceux-ci incluent les éléments carbone et hydrogène. Le nombre d'atomes de carbone dans les trois classes MATCHES, le contraste est observé que dans le nombre d'hydrogène qui peut être coupé ou rejoindre. les hydrocarbures saturés de composés insaturés obtenus. Les représentants des paraffines contenues dans la molécule est de 2 atome d'hydrogène de plus que l'oléfine, ce qui confirme la formule générale des alcanes, des alcènes. la structure est considérée comme alcènes en raison de la présence d'une double liaison insaturée.
Si l'on compare le nombre d'atomes d'hydrogène et de carbone dans l'alcane, la valeur maximale sera comparée à d'autres classes d'hydrocarbures.
Etant donné que le butane de méthane et de fin (C 1 à C 4), il existe des substances sous forme gazeuse.
Sous forme liquide, présente des hydrocarbures période homologue de C 5 à C 16. Depuis alcane ayant dans la chaîne principale de 17 atomes de carbone, une transition de l'état physique sous une forme solide.
Ils sont caractérisés par une isomérie du squelette carboné et modifications optiques de la molécule. 
Les paraffines valences de carbone sont considérés comme des atomes de carbone adjacents entièrement occupés ou un atome d'hydrogène pour former une connexion de type σ. D'un point de vue chimique, ce qui provoque leurs propriétés les plus faibles, ce qui explique pourquoi les alcanes sont appelés limiter ou des hydrocarbures saturés dépourvus d'affinité.
Ils entrent dans des réactions de substitution liées à halogénation par un type radical nitration sulfochlorage ou molécule.
Les paraffines sont soumis à un processus d'oxydation, combustion ou décomposition à des températures élevées. Dans le cadre des accélérateurs à action réactions de clivage interviennent un atome d'hydrogène ou de déshydrogénation d'alcanes.
Qu'est-ce que alcynes
Ils sont aussi appelés hydrocarbures acétyléniques, dans lequel le carbone est présent dans la chaîne triple liaison. La structure de l'alcyne décrit par la formule générale C n H 2 n-2. On peut constater que, contrairement aux alcanes à partir d'hydrocarbures acétyléniques manque quatre atomes d'hydrogène. Ils remplacent la triple liaison, formée par deux connexions en n.
Cette structure détermine les propriétés chimiques de cette classe. La formule structurelle d'alcènes et d' alcynes démontre une insaturation des molécules et la présence de la double (H 2 C꞊CH 2) et la connexion triple (HC≡CH).
Nom alcynes et leurs caractéristiques
Le représentant le plus simple est l'acétylène ou HC≡CH. Il est aussi appelé éthynyle. Il dérive du nom de l'hydrocarbure saturé, qui a supprimé le suffixe -an et ajoutez -in. Dans les noms de la figure à long alcyne indiquer l'emplacement de la triple liaison.
La connaissance de la structure de l'hydrocarbure saturé ou insaturé, il peut être déterminé par lettre désigne la formule générale pour les alcynes: a) CnH2n; a) CnH2n + 2; c) CnH2n-2; g) CnH2n-6. La bonne réponse est la troisième option.
A partir de butane acétylène et de fin (C 2 à C 4), les substances sont gazeux dans la nature. 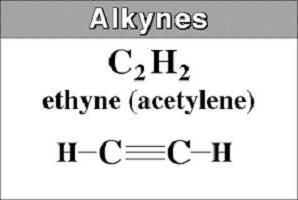
Dans les hydrocarbures sous forme liquide sont homologues période de C 5 à C 17. En commençant par alcyne ayant dans la chaîne principale de 18 atomes de carbone, une transition de l'état physique sous une forme solide.
Ils sont caractérisés par une isomérie du squelette carboné, sur la situation des communications triples et interclasse modification molécule.
Selon les caractéristiques chimiques similaires alcènes en hydrocarbures acétyléniques.
Si la triple liaison alcyne terminal, ils fonctionnent pour former des sels d'un alkinidov de fonction acide, par exemple, NaC≡CNa. La présence de deux liaisons tc rend la molécule un fort de sodium nucléophile atsetiledina entrer dans des réactions de substitution.
L'acétylène est chloré en présence de chlorure de cuivre pour obtenir le dichloroacétyle, la condensation sous l'action d'une libération des molécules halogénoalcynyle diacétyléniques.
Alcynes participent à des réactions d'addition électrophiles, le principe qui sous-tend la gidrogalogenirovaniya d'halogénation, l'hydratation et carbonylation. Cependant, ces processus sont plus faibles que celui des alcènes avec une double liaison.
Pour les hydrocarbures acétyléniques peuvent nucléophile réaction d'addition de la molécule de type alcool, une amine primaire ou sulfure.














