Formule d'ammoniaque. L'hydroxyde d'ammonium est une solution aqueuse d'ammoniac
Ammoniac – nitrure d'hydrogène – l'un des composés les plus importants d'azote et d'hydrogène. C'est un gaz sans couleur, mais avec une odeur piquante. La composition chimique reflète la formule de l'ammoniac – NH 3 . L'augmentation de la pression ou l'abaissement de la température de la substance conduit à sa transformation en un liquide incolore. L'ammoniac gazeux et ses solutions sont largement utilisés dans l'industrie et l'agriculture. En médecine, on utilise 10% d'hydroxyde d'ammonium – ammoniac.
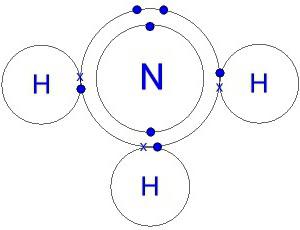
La structure de la molécule. Formule électronique d'ammoniac
La molécule de nitrure d'hydrogène en forme ressemble à une pyramide, dont la base est l'azote, reliée à trois atomes d'hydrogène. Les liaisons N-H sont fortement polarisées. L'azote attire plus fortement la paire d'électrons de liaison. Par conséquent, la charge négative s'accumule sur les atomes N, la charge positive est concentrée sur l'hydrogène. Le modèle de la molécule, la formule électronique et structurelle de l' ammoniac, donne une idée de ce processus.
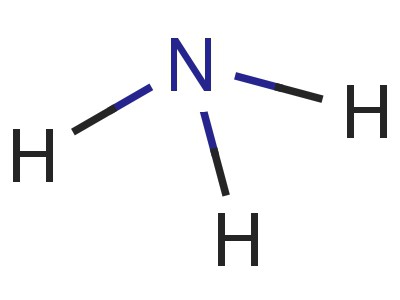
Le nitrure d'hydrogène se dissout très bien dans l'eau (700: 1 à 20 ° C). La présence de protons pratiquement libres conduit à la formation de nombreux "ponts" d'hydrogène qui relient les molécules ensemble. Les caractéristiques de la structure et la liaison chimique entraînent également le fait que l'ammoniac est facilement liquéfié en augmentant la pression ou en abaissant la température (-33 ° C).

Origine du nom
Le terme «ammoniac» a été introduit dans la pratique scientifique en 1801 à la suggestion du chimiste russe Ya. Zakharov, mais la substance de l'humanité est familière depuis l'Antiquité. Le gaz avec une odeur piquante est libéré lors de la décomposition des produits d'activité vitale, de nombreux composés organiques, par exemple des protéines et de l'urée, lors de la décomposition de sels d'ammonium. Les historiens de la chimie croient que la substance a été nommée d'après le dieu égyptien d'Amon ancien. En Afrique du Nord, il y a une oasis de Siwa (Ammon). Entouré par le désert libyen, il y a des ruines d'une ville ancienne et d'un temple, à côté de laquelle se trouvent des dépôts de chlorure d'ammonium. Cette substance en Europe s'appelait "le sel d'ammoniaque". Il y a une légende selon laquelle les habitants de l'Oasis Siva ont reniflé le sel dans le temple.
Préparation du nitrure d'hydrogène
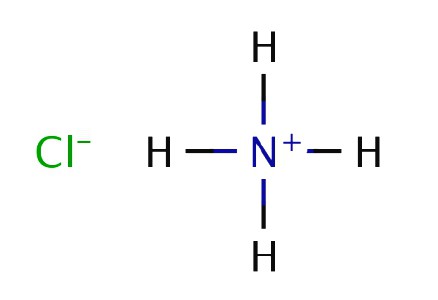
Le physicien et chimiste anglais Boyle a brûlé du fumier dans des expériences et a observé la formation de fumée blanche sur un bâton trempé dans de l'acide chlorhydrique et introduit dans le jet du gaz résultant. En 1774, un autre chimiste britannique, D. Priestley, a chauffé le chlorure d'ammonium avec de la chaux hydratée et séparé la substance gazeuse. Priestley a appelé le composé "air alcalin", car sa solution a montré les propriétés d'une base faible. L'expérience de Boyle, dans laquelle l'ammoniac a réagi avec de l'acide chlorhydrique, a été expliquée. Le chlorure d'ammonium blanc solide se produit lorsque des molécules de substances réactives entrent directement en contact direct.
La formule chimique de l'ammoniac a été établie en 1875 par le Français C. Bertolle, qui a mené une expérience sur la décomposition de la matière en composants composites sous l'action d'une décharge électrique. Jusqu'à présent, les expériences de Priestley, Boyle et Berthollet sont reproduites dans des laboratoires pour la production de nitrure d'hydrogène et de chlorure d'ammonium. La méthode industrielle a été développée en 1901 par A. Le Chatelier, qui a reçu un brevet pour la méthode de synthèse de la matière à partir de l'azote et de l'hydrogène.
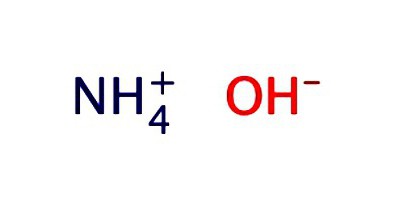
Solution d'ammoniaque. Formule et propriétés
Une solution aqueuse d'ammoniac est généralement enregistrée sous forme d'hydroxyde – NH 4 OH. Il présente les propriétés d'un alcali faible:
- Dissocie en des ions NH 3 + H 2 O = NH 4 OH = NH 4 + + OH – ;
- Colorer la solution de phénolphtaléine en couleur cramoisie;
- Interagir avec les acides pour former du sel et de l'eau;
- Précipite le Cu (OH) 2 sous forme de substance bleu vif lorsqu'il est mélangé avec des sels de cuivre solubles.
L'équilibre dans la réaction de l'ammoniac avec de l'eau est déplacé vers les matériaux de départ. Le nitrure d'hydrogène préchauffé brûle bien dans l'oxygène. L'oxydation de l'azote se produit à des molécules diatomiques de matière simple N2. Les propriétés réductrices de l'ammoniac se manifestent également dans la réaction avec l'oxyde de cuivre (II).

La valeur de l'ammoniac et ses solutions
Le nitrure d'hydrogène est utilisé dans la production de sels d'ammonium et d'acide nitrique, l'un des produits les plus importants de l'industrie chimique. L'ammoniac sert de matière première pour la production de soude (selon la méthode des nitrates). La teneur en nitrure d'hydrogène dans une solution concentrée industrielle atteint 25%. Dans l'agriculture, on utilise une solution aqueuse d'ammoniaque. La formule pour l'engrais liquide est NH 4 OH. La substance est directement utilisée comme pansement supérieur. D'autres façons d'enrichir le sol avec de l'azote sont l'utilisation de sels d' ammonium: nitrates, chlorures, phosphates. Dans les conditions industrielles et les locaux agricoles, il n'est pas recommandé de stocker des engrais minéraux contenant des sels d'ammonium avec des alcalis. Si l'intégrité de l'emballage est violée, les substances peuvent réagir l'une avec l'autre pour former de l'ammoniaque et la libérer dans l'air des locaux. Le composé toxique affecte négativement le système respiratoire, le système nerveux central de l'homme. Un mélange d'ammoniac et d'air est explosif.












