A partir de la période antique jusqu'au milieu du 18ème siècle, la science a été dominée par l'idée que l'atome – une particule de matière qui ne peut pas être divisé. scientifique et naturaliste anglais, et D. Dalton a donné une définition de l'atome comme la plus petite partie d'un élément chimique. MV Lomonosov dans sa doctrine atomique et moléculaire a été en mesure de donner une définition de l'atome et de la molécule. Il était convaincu que la molécule, qu'il appelait « corpuscules », composé de « éléments » – atomes – et sont en mouvement constant.
D. I. Mendeleïev a cru que cette substance sous-unités qui composent le monde matériel, conserve toutes ses propriétés que si elle n'est pas soumise à la division. Dans cet article, nous définissons un objet comme un microcosme de l'atome, et d'étudier ses propriétés.
Arrière-plan de la théorie de la structure atomique
Au 19ème siècle, il est largement reconnu que la déclaration sur l'indivisibilité de l'atome. La plupart des chercheurs ont estimé que les particules d'un élément chimique en aucun cas ne peuvent pas être transformés en atomes des autres éléments. Ces idées ont été la base sur laquelle était basée la définition d'un atome jusqu'en 1932. A la fin du 19ème siècle dans la science ont été fait des découvertes fondamentales qui ont changé ce point de vue. Tout d'abord, en 1897, le physicien britannique J. J. Thomson avait découvert l'électron. Ce fait est fondamentalement changé les idées des scientifiques sur une partie indivisible de l'élément chimique.
Comment prouver que l'atome structure complexe
Même avant la découverte de l'électron , les scientifiques d' accord à l' unanimité que les atomes ont sans frais. Ensuite, on a découvert que les électrons se distinguent facilement de tout élément chimique souhaité. Ils se trouvent dans une flamme, ils sont porteurs de courant électrique, ils libèrent des substances pendant rayons x.

Mais si les électrons font partie de tous, sans exception, et les atomes chargés négativement, donc, dans un atome il y a des particules qui ne manqueront pas d'avoir une charge positive, sinon les atomes ne seraient pas électriquement neutre. Pour aider à simplifier la structure de l'atome a contribué à un phénomène physique que la radioactivité. Il a donné la définition correcte de l'atome en physique, puis la chimie.
Les rayons invisibles
physicien français A. Becquerel fut le premier à décrire le phénomène d'émission d'atomes de certains éléments chimiques, visuellement rayons invisibles. Ils ionisent le passage d'air à travers le matériau, ce qui provoque le noircissement des plaques photographiques. Plus tard, les Curie et Rutherford ont trouvé que les substances radioactives se transforment en atomes d'autres éléments chimiques (tels que l' uranium – neptunium).
radiation radioactive est non uniforme dans la composition: les particules alpha, particules bêta, rayons gamma. Ainsi, le phénomène de la radioactivité démontré que la classification périodique des éléments particules ont une structure complexe. Ce fait a causé les modifications apportées à la définition de l'atome. Quelles sont les particules est un atome, donné par Rutherford a obtenu de nouveaux faits scientifiques? La réponse à cette question était le modèle nucléaire savant proposé de l'atome, selon lequel les électrons autour du noyau chargés positivement se déplacent.
Rutherford modèle Contradictions
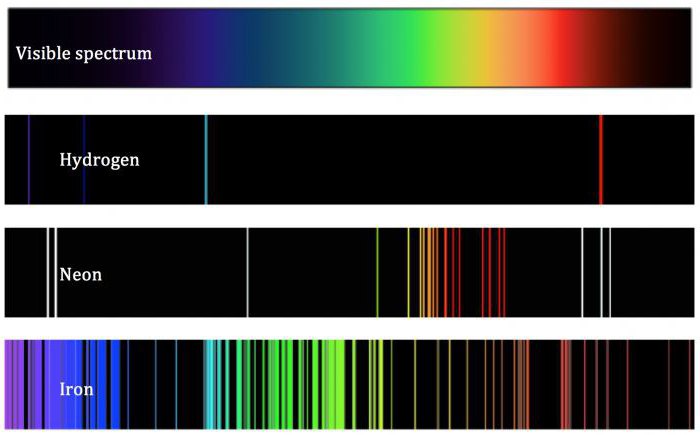
La théorie du savant, malgré son caractère exceptionnel, ne pouvait pas définir objectivement l'atome. Ses conclusions étaient contraires aux lois fondamentales de la thermodynamique, selon laquelle tous les électrons en orbite autour des noyaux perdent leur énergie et, comme il peut être, tôt ou tard tomber sur lui. Atom dans ce cas détruit. Ceci est en fait pas le cas, puisque les produits chimiques et les particules à partir de laquelle elles sont faites, existent dans la nature depuis longtemps. atome Inexplicablement telle détermination basée sur la théorie de Rutherford, ainsi que le phénomène qui se produit lors du passage des substances simples à chaud à travers un réseau de diffraction. Après spectres atomiques formés en même temps avoir une forme linéaire. Ce conflit avec le modèle Rutherford de l'atome, selon lequel le spectre devrait être continu. Selon les concepts de la mécanique quantique, les électrons présents dans le noyau ne sont pas caractérisés comme des objets ponctuels, ainsi que de la forme du nuage d'électrons.

La plupart de sa densité dans un certain lieu de l'espace autour du noyau, et est considéré comme l'emplacement d'une particule à un moment donné. En outre, on a trouvé que l'atome, les électrons sont disposés en couches. Le nombre de couches peut être déterminée en connaissant le nombre de la période dans laquelle l'élément dans le périodique D. I. Système Mendeleeva. Par exemple, l'atome de phosphore contient 15 électrons et a trois niveaux d'énergie. L'indicateur, qui détermine le nombre de niveaux d'énergie est appelée le nombre quantique principal.
Il a été établi expérimentalement que le niveau d'énergie des électrons, situé le plus proche du noyau, ont la plus faible énergie. Chaque coquille d'énergie est divisée en sous-niveaux, et, à leur tour, sur les orbitals. Les électrons sont situés à différentes orbitales ont les mêmes nuages de forme (s, p, d, f).
Sur la base de ce qui précède, il résulte que la forme du nuage électronique ne peut pas être arbitraire. Il est strictement déterminé en fonction de l'orbitale nombre quantique. Nous ajoutons également que l'état de l'électron à la particule est également déterminée par deux valeurs – magnétique et de spin nombres quantiques. La première est basée sur l'équation de Schrödinger et caractérise l'orientation spatiale du nuage d'électrons sur la base des trois-dimensionnalité de notre monde. Le deuxième indicateur – le nombre de rotation sur elle détermine la rotation de électron autour de son axe ou dans le sens antihoraire.
La découverte du neutron
Grâce au travail de D. Chadwick, les tint en 1932, il a été donné une nouvelle définition de l'atome dans la chimie et la physique. Dans leurs expériences scientifiques, il a prouvé que dans le clivage se produit le rayonnement polonium provoquée par les particules ayant sans frais, la masse 1,008665. Une nouvelle particule élémentaire a été nommé le neutron. Sa découverte et l'étude de ses propriétés ont permis aux scientifiques soviétiques V. Gapone et Ivanenko créer une nouvelle théorie de la structure du noyau atomique, contenant des protons et des neutrons.
Selon la nouvelle théorie, la détermination de la substance a eu l'atome suivant forment une unité structurelle de l'élément chimique, constitué d'un noyau contenant des protons, des neutrons et des électrons qui se déplacent autour d'elle. Le nombre de particules positives dans le noyau est toujours égal au nombre ordinal de l'élément chimique dans le système périodique.
Plus tard, le professeur Jdanov dans ses expériences ont confirmé que, sous l'influence du rayonnement cosmique dur, les noyaux atomiques sont divisés en protons et neutrons. De plus, il a été prouvé que les forces de maintien de ces particules élémentaires dans le noyau, il est extrêmement consommatrice d'énergie. Ils agissent sur des distances très courtes (de l'ordre de 10 -23 cm), appelée nucléaire. Comme mentionné précédemment, par MV Lomonosov a pu donner une définition de l'atome et la molécule sur la base des faits scientifiques qui lui sont connus.

À l'heure actuelle reconnu considérons le modèle suivant: atome est constitué d'un noyau et d'électrons qui se déplacent dans un chemin strictement définis – orbitals. Électrons en même temps présentent les propriétés des deux particules et des ondes, qui est, ont une double nature. Le noyau d'un atome est concentrée presque toute sa masse. Il se compose de protons et de neutrons associés aux forces nucléaires.
Que ce soit possible de peser atome
Il se trouve que chaque atome de masse. Par exemple, il est de l' hydrogène 1,67h10 -24 a même été difficile d'imaginer comment cette petite valeur. Pour trouver le poids de l'objet, ne pas utiliser les échelles, et l'oscillateur, qui est un nanotube de carbone. Pour calculer le poids de l'atome et de la molécule plus de quantité convenable est le poids relatif. Il montre combien de fois le poids d'une molécule ou un atome plus de 1/12 de l'atome de carbone, qui est 1,66h10 -27 kg. masses atomiques relatives sont données dans le tableau périodique des éléments chimiques, et ils ont aucune dimension.
Les scientifiques sont bien conscients que le poids atomique d'un élément chimique – est le nombre moyen de masse d'isotopes. Il apparaît, dans la nature d'une unité d'un élément chimique peut avoir des masses différentes. Ainsi, les charges des noyaux de ces particules de structure identique.
Les scientifiques ont constaté que les isotopes diffèrent en nombre de neutrons dans le noyau et les noyaux les charger identiques. Par exemple, un atome de chlore, ayant une masse 35 contenait 18 neutrons et 17 protons, et avec une masse de 37 – 20 protons et 17 neutrons. De nombreux éléments chimiques sont des mélanges d'isotopes. Par exemple, les substances simples tels que le potassium, l'argon, l'oxygène contenu dans ses atomes de composition représentant trois isotopes différents.
Détermination de l'atomicité
Il a plusieurs interprétations. Pensez à ce que l'on entend par ce terme en chimie. Si peuvent exister au moins momentanément les atomes d'un élément chimique dans l'isolement, n'a pas tendance à former des particules plus complexes – molécules, alors on dit que ces substances ont une structure atomique. Par exemple, la réaction de chloration en plusieurs étapes de méthane. Il est largement utilisé dans la chimie de synthèse organique pour les principaux dérivés halogénés: le dichlorométhane, le tétrachlorure de carbone. Il est divisé molécules de chlore à des atomes ayant une réactivité élevée. Ils détruisent les liaisons sigma dans la molécule de méthane, en fournissant une réaction de substitution de la chaîne.
Un autre exemple d'un procédé chimique ayant une grande importance dans l'industrie – l'utilisation de peroxyde d'hydrogène comme agent désinfectant et de blanchiment. Dosage de l'oxygène atomique en tant que produit de clivage de peroxyde d'hydrogène se produit dans les deux cellules vivantes (par l'enzyme catalase), et dans le laboratoire. L' oxygène atomique qualitativement déterminée par ses propriétés antioxydantes élevées et leur capacité à détruire les agents pathogènes: bactéries, les champignons et leurs spores.

Comment l'enveloppe nucléaire
Nous avons précédemment découvert que l'unité structurelle d'un élément chimique a une structure complexe. Autour des particules de noyau à charge positive tourner électrons négatifs. Le prix Nobel Niels Bohr, basée sur la théorie quantique de la lumière, a créé un enseignement, dans lequel la caractérisation et l'identification des atomes sont les suivants: le déplacement des électrons autour du noyau seulement à certains chemins fixes dans ce cas, ne rayonnent pas d'énergie. Bohr, les scientifiques ont montré que les particules du micromonde, qui comprennent les atomes et les molécules ne respectent pas les lois en vigueur pour les grands corps – objets macrocosme.
La structure des coquilles d'électrons de particules a été étudié dans les documents sur les scientifiques de la physique quantique tels que Hund, Pauli Klechkovskii. Comme il est devenu connu que les électrons font le mouvement de rotation autour du noyau est pas chaotique, mais sur certains chemins fixes. Pauli a constaté que dans un seul niveau d'énergie à chacune de ses orbitales s, p, d, f dans les cellules électroniques peuvent être pas plus de deux particules chargées négativement de la valeur de rotation opposé et + ½ – ½.
La règle de Hund explique comment remplir orbitales électroniques avec le même niveau d'énergie.
Aufbau principe, également appelé la règle n + l, expliquent comment les orbitales remplies multielectron atomes (éléments 5, 6, 7 cycles). Tous les régularités ci-dessus a servi de base théorique des éléments chimiques créés par Dmitriem Mendeleevym.
degré d'oxydation
Il est un concept fondamental dans la chimie et décrit l'état d'un atome dans une molécule. La définition moderne du degré d'oxydation des atomes est la suivante: la charge est conditionnée atomes dans la molécule, qui est calculé sur les concepts qu'une molécule a seulement la composition ionique.
L'oxydation peut être exprimée par un nombre entier ou un nombre fractionnaire, a des valeurs positives, négatives ou nulles. Dans la plupart des atomes d'éléments chimiques ont plusieurs états d'oxydation. Par exemple, l'azote est -3, -2, 0, +1, +2, +3, +4, +5. Mais un tel élément, tel que le fluor, dans toutes ses composés n'a qu'un seul état d'oxydation égal à -1. Si elle est présentée une substance simple, son état d'oxydation de zéro. Cette quantité chimique pratique à utiliser pour la classification des substances et de décrire leurs propriétés. Dans la plupart des cas, le degré de la chimie de l'oxydation utilisé dans la mise en place des réactions d'oxydo-réduction des équations.
Les propriétés des atomes
Merci aux découvertes de la physique quantique, la définition moderne de l'atome, qui est basé sur la théorie Ivanenko et Gapone E, complété par les faits scientifiques suivants. La structure d'un noyau atomique ne change pas au cours des réactions chimiques. Le changement ne concerne que les orbitales électroniques fixes. Leur structure peut être attribuée à un grand nombre de propriétés physiques et chimiques des substances. Si l'électron quitte une orbite stationnaire et procède à l'orbite avec une énergie plus élevée tel atome est appelé excité.

Il convient de noter que les électrons ne peuvent pas être longtemps sur ces orbitales non essentielles. En revenant à son orbite stationnaire, l'électron émet le quantum d'énergie. L'étude de ces caractéristiques des unités structurales des éléments chimiques que l'affinité électronique, l'électronégativité, l'énergie d'ionisation, a permis aux scientifiques non seulement de définir l'atome comme un microcosme de particules essentiel, mais aussi leur a permis d'expliquer la capacité d'atomes pour former un état moléculaire stable et énergétiquement plus favorable de la matière, une conséquence possible de la création de tout type de liaisons chimiques stables: ionique, covalente polaire et apolaire, donneur-accepteur (comme des espèces de liaison covalente) et m etallicheskoy. Ce dernier détermine les principales propriétés physiques et chimiques des métaux.
Il a été établi expérimentalement que la taille d'un atome peut varier. Tout dépendra de la molécule dans laquelle il est inclus. Grâce à l'analyse de diffraction des rayons X permet de calculer la distance entre les atomes dans un composé chimique, ainsi que d'apprendre unité d'élément de structure de rayon. Posséder modèles de changement de rayons des atomes contenus dans la période ou le groupe d'éléments chimiques, il est possible de prédire leurs propriétés physiques et chimiques. Par exemple, au cours des périodes de plus en plus avec le noyau atomique chargent leur diminution de rayons ( « atome de compression »), et donc affaiblir les propriétés métalliques des composés, et non métalliques amplifiés.
Ainsi, la connaissance de la structure de l'atome peut déterminer avec précision les propriétés physiques et chimiques de l'ensemble des éléments compris dans le système périodique des éléments.









