Qu'est-ce que allotropy? allotrope de carbone, Chemistry
Raisons variété de composés organiques – la capacité à former des différentes chaînes et cycles d'atomes de carbone sont interconnectés. C'est le phénomène de isomérie. Et la raison de la variété de simples substances inorganiques? Il se trouve que vous pouvez répondre à cette question en considérant ce qui Allotropy. Il est à ce phénomène naturel dans le monde des éléments chimiques se lient l'existence de différentes formes de composés simples.
Qu'est-ce que allotropy?
Répondre à cette question peut être. Ce phénomène est l'existence d'un même élément chimique sous la forme de plusieurs substances simples. Autrement dit, si la cellule 118 dans le tableau périodique, cela ne signifie pas que le même nombre d'atomes dans la nature. Chacun des éléments (presque tous) ont une ou plusieurs variétés, ou des modifications allotropiques.
Ce qui est différent de ces substances? Les raisons de ce phénomène en question sont essentiellement deux:
- un nombre différent d'atomes de carbone dans la molécule (allotropy composition);
- structure de réseau inégale (allotropie de forme).
Souvent, le concept est associé au polymorphisme terme. Cependant, il y a une différence entre eux. Qu'est-ce que allotropy? Cette modification des éléments chimiques dans différentes substances simples, peu importe que ce soit dans un état d'agrégation. Alors que le polymorphisme – ce concept est applicable uniquement aux solides substances cristallines.
Diverses modifications allotropiques composés généralement désignés par les lettres romaines avant le nom. Alpha est toujours placé en face de la forme, qui a une température minimale de fusion de l'ébullition. Plus bas l'alphabet et une augmentation des performances, respectivement.
Bien que l'élément chimique dans la base de substance simple, les mêmes propriétés de modifications significativement différents les uns des autres, et à la fois physique et chimique. La meilleure façon de former les formes allotropiques:
- non-métaux (à l'exception des halogènes et des gaz inertes);
- métalloïdes.
Moins Allotropy métaux étudiés car ils forment une réticentes ces modifications et pas tous. Total à ce jour, il y a plus de 400 différentes formes de substances simples. Le plus caractéristique de l'oxydation de l'élément, plus le nombre de modifications allotropiques dont elle a connaissance.

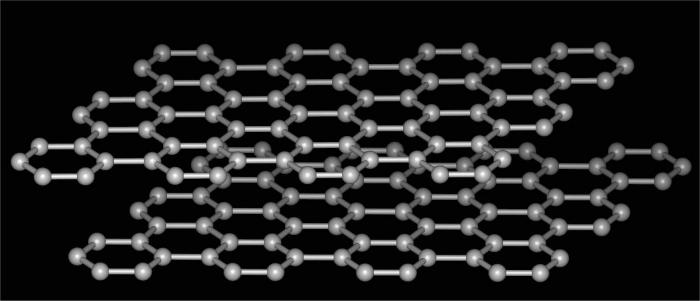
modifications de carbone
allotrope de carbone – est l'exemple le plus commun et frappant illustrant le phénomène en question. Après tout, cet élément est apte à former plusieurs sortes de composés différents structure de réseau cristallin. Dans cette image d'une substance simple de ces pôles opposés dans leurs propriétés que les décisions sont laissées à merveille de la nature.
Ainsi, un allotrope de carbone comprend les modifications suivantes.
- Qu'est-ce qu'un allotrope de carbone, peut être tracé et suivant sa forme, ce qui est fondamentalement différent du précédent. Ce graphite. substance très douce, qui peut écailler facilement et laisser une marque distinctive sur le papier. Par conséquent, son utilisation pour la fabrication de poignées sont des crayons simples. La structure de cette forme – la couche hexagonale. Les connexions entre les couches sont faibles, facile à déchirer, la matière de faible densité. Le graphite est utilisé pour produire des diamants synthétiques en tant que lubrifiant solide, pour la fabrication d'électrodes comme matière de remplissage en matière plastique, et dans les réacteurs nucléaires.
- Fullerènes – une autre preuve qu'il y Allotropy. Composition chimique de ces composés est similaire à celle des hydrocarbures aromatiques. Parce que leur structure est fermée polyèdres convexe, ressemblant à un ballon de football. Les fullerènes sont appliqués en tant que semi-conducteur dans la technique pour la production de composés supraconducteurs comme résine photosensible et d'autres.
- Lonsdalite tserafit et – deux autre modification allotropique cristalline du carbone. Il a été découvert récemment. Par des propriétés très similaires à diamant, en l'absence d'impuretés peut être encore plus difficile à plusieurs reprises.
- Du charbon et de suie – Allotropy substances amorphes. Utilisé comme carburant, les lubrifiants, les filtres et ainsi de suite. Selon le contenu de la nature de la plus commune de toutes les modifications du carbone.

diamant
Le plus dur de toutes les substances connues à ce jour, estimé à 10 points sur l'échelle de Mohs. La forme cristalline du carbone, de la structure qui est de la forme d'entités de réseau tétraédriques correctement interconnectés.
Le diamant est très bien capable de diffuser la lumière, il peut être utilisé comme bijoux (diamants). En raison de son extrême dureté, est utilisé pour la coupe et le soudage, le perçage, le polissage et meulage. Aujourd'hui , a lancé la production de diamants artificiels utilisés dans l' industrie.
d'autres espèces
En outre, il existe plusieurs variétés de cet élément:
- nanotubes;
- nanomousse;
- astrolite;
- nanofibres;
- vitreux;
- graphite;
- carabine;
- nanobuds.
formes probables, mais putatifs de l'existence de composés de carbone simples: chaoit, carbone et dicarbon métallique.
allotropy d'oxygène
Cette forme de deux substance simple non métallique:
- de l' oxygène gazeux (dans des conditions normales), dont la formule O 2;
- gaz d'ozone, la composition empirique, dont la réflexion O 3.
Il est évident que là est la principale raison de l'existence de modifications – la molécule. oxygène normal – la base de la vie pour tous les êtres vivants (sauf pour les bactéries anaérobies). Il participe activement à l'échange de gaz, la source d'énergie pour tous les processus de la vie. Chimiquement – oxydant, grâce à quoi une pluralité de réactions est effectuée.
L'ozone se forme dans la nature ou l'oxygène de l'équipement de laboratoire spécial de l'air par une forte décharge électrique. Dans des conditions naturelles – c'est la foudre. A de faibles concentrations de traces, il a une nouvelle odeur agréable (après la tempête a toujours senti dans l'air). Il est un oxydant très puissant, eau de javel, chimiquement actif.

modification du phosphore
Allotropy oxygène est similaire à celle du phosphore et. Il dispose également d'environ 11 différentes modifications différentes nombre d'atomes dans la molécule, et par conséquent, une liaison chimique et les propriétés. Il existe trois formes stables, et le reste, dans la nature pratiquement ne se produit pas, et en décomposition.
- Le phosphore blanc. Il Formule F 4. Une substance ressemblant à la paraffine molle blanche ou de couleur légèrement jaunâtre. Il est facile de fondre, se transformant en gaz toxiques.
- Le phosphore rouge – une pâte, qui a une odeur désagréable. Formule – P n. Cette structure du polymère.
- phosphore noir – gras au poids tactile, qui est de couleur noire et complètement soluble dans l'eau.
modification par un métal
Qu'est-ce que Allotropy métaux, se trouve sur l'exemple du fer. Il existe sous la forme de:
- alpha;
- bêta;
- gamma;
- forme de sigma.
Chaque diffère de la structure antérieure du réseau cristallin et, par conséquent, les propriétés. Par exemple, l'alpha-forme – ferromagnetichna et -paramagnetik bêta.
En règle générale, tous les métaux connus de modification allotropique pour former un total de 27 éléments chimiques.

allotropy d'étain
Intéressant en ce que la forme alpha – une poudre grise, qui existe seulement à de basses températures. Beta-forme, d'autre part, le métal, blanc argenté, doux et ductile. Il est à la performance à haute température – jusqu'à 161 ° C. Une forme est aisément convertie en une autre in vivo, si la chute de degré.















