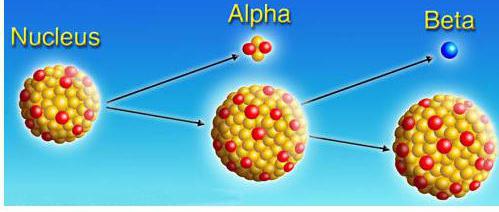
L'histoire de l'étude de la radioactivité a commencé le 1er Mars 1896, lorsque le célèbre scientifique français Anri Bekkerel découvert par hasard une chose étrange dans le rayonnement des sels d'uranium. Il est apparu que la plaque photographique, placé dans une boîte avec un échantillon gâchée. Il est le résultat des pays possédant un rayonnement pénétrant élevé, ce qui a enrichi l'uranium. Cette propriété se trouve dans les éléments les plus lourds, complétant le tableau périodique. On lui a donné le nom de « radioactivité ».
Nous présentons les caractéristiques de la radioactivité
Ce processus – isotope de l'élément de conversion spontanée d'atomes dans un isotope différent avec évolution simultanée des particules élémentaires (électrons, des noyaux atomiques de l'hélium). atomes de conversion sont apparus spontanément, sans nécessiter l'absorption d'énergie externe. La quantité principale caractérisant la libération d'énergie au cours du processus de désintégration radioactive, activité appelée.
 activité échantillon radioactif appelé nombre probable de la désintégration de l'échantillon par unité de temps. Dans le SI (système international) unité de mesure , il est appelé le becquerel (Bq). Dans une Becquerel a adopté une telle activité de l'échantillon qui se produit en moyenne une désintégration par seconde.
activité échantillon radioactif appelé nombre probable de la désintégration de l'échantillon par unité de temps. Dans le SI (système international) unité de mesure , il est appelé le becquerel (Bq). Dans une Becquerel a adopté une telle activité de l'échantillon qui se produit en moyenne une désintégration par seconde.
A = lambda N, dans lequel la constante de désintégration λ-, N – nombre d'atomes actifs dans l'échantillon.
α isolé, β, y-caries. Les équations correspondantes sont appelées règles de compensation:
|
nom |
Qu'est – ce qui se passe |
équation de la réaction |
|
α désintégration |
conversion du noyau atomique dans le noyau X Y libération de noyau d'un atome d'hélium |
X Z A → Z-Y 2 A-4 + 4 2 Il |
|
β – désintégration |
conversion du noyau atomique dans le noyau X Y avec la sortie d'électrons |
Z A → Z + X 1 Y A + -1 A e |
|
γ – décomposition |
pas accompagnée de changements dans le noyau, l'énergie libérée sous la forme d'une onde électromagnétique |
X Z X Z A → A + γ |
L'intervalle de temps de la radioactivité
Le moment de la chute des particules ne peut pas être réglé pour l'atome particulier. Pour lui, il est plutôt un « accident » plutôt qu'un motif. Isolement de l'énergie qui caractérise le procédé, défini comme étant l'activité de l'échantillon.
 On remarque que cela change au fil du temps. Bien que les éléments individuels présentent un degré surprenant de constance de rayonnement, il existe des substances dont l'activité diminue à plusieurs reprises dans un court laps de temps. variété incroyable! Est-il possible de trouver un modèle dans ces processus?
On remarque que cela change au fil du temps. Bien que les éléments individuels présentent un degré surprenant de constance de rayonnement, il existe des substances dont l'activité diminue à plusieurs reprises dans un court laps de temps. variété incroyable! Est-il possible de trouver un modèle dans ces processus?
Il est établi qu'il ya un temps pendant lequel exactement la moitié des atomes de l'échantillon en cours de décomposition. Cet intervalle de temps est appelée « demi-vie ». Quel est le sens de l'introduction de ce concept?
Quelle est la demi-vie?
Il semble que pour une durée égale à la période, exactement la moitié des atomes actifs présents pauses d'échantillons. Mais cela signifie que pendant tous les atomes actifs se désintégrer complètement en deux demi-vies? Pas du tout. Après un certain point dans l'échantillon est la moitié des éléments radioactifs, par la même quantité d'atomes restants de temps se décompose même la moitié, et ainsi de suite. Le rayonnement persiste pendant une longue période, beaucoup plus élevé que la demi-vie. Par conséquent, les atomes actifs dans l'échantillon sont stockées indépendamment dans le rayonnement
La demi-vie – une quantité qui ne dépend que des propriétés de la substance. La valeur est définie pour de nombreux isotopes radioactifs connus.
Tableau: « La décroissance demi-vie de certains isotopes »
| nom |
désignation |
type de désintégration |
demi-vie |
|
radium |
88 Ra 219 |
alpha |
0,001 secondes |
|
magnésium |
12 Mg 27 |
bêta |
10 minutes |
|
radon |
86 Rn 222 |
alpha |
3,8 jours |
|
cobalt |
27 Co 60 |
bêta, gamma |
5,3 ans |
|
radium |
88 Ra 226 |
alpha, gamma |
1620 ans |
|
Uranus |
92 238 U |
alpha, gamma |
4,5 milliards d'années |
Détermination de la demi-vie réalisée expérimentalement. Dans des études de laboratoire menées à plusieurs reprises mesurer l'activité. Puisque les échantillons de laboratoire de taille minimale (chercheur en sécurité est avant tout), l'expérience est réalisée avec des intervalles différents, répété plusieurs fois. Il est basé sur la régularité de l'activité des agents de changement.
Afin de déterminer la demi-vie est l'activité mesurée de l'échantillon à des intervalles de temps spécifiques. Étant donné que le paramètre lié à la quantité d'atomes désintégrés de la loi de désintégration radioactive, la détermination de la demi-vie.
Définitions exemple pour l'isotope
Soit le nombre d'éléments actifs de l'isotope à un instant donné est égal à N, l'intervalle de temps pendant lequel l' observation est t 2 – t 1 où le début et la fin sont suffisamment proches l' observation. On suppose que n – nombre d'atomes désintégré dans un intervalle de temps donné, alors n = KN (t 2 – t 1).
Dans cette expression, K = 0693 / T½ – facteur de proportionnalité, appelé constante de désintégration. T½ – la demi-vie de l'isotope.
Supposons pour l'unité de tranche de temps. Ainsi, K = n / N indique la fraction de noyaux des isotopes présents de désintégration par unité de temps.
Connaissant la valeur de la constante de décroissance peut être déterminée et la demi-vie de décomposition: T½ = 0693 / K.
Il en résulte que par unité de temps se brise pas un certain nombre d'atomes actifs, et une certaine proportion.
La loi de désintégration radioactive (spp)
La demi-vie est la base spp. Motif dérivé Frederick Soddy et Ernest Rutherford sur la base des résultats expérimentaux en 1903. Il est surprenant que plusieurs mesures effectuées avec des instruments qui sont loin d'être parfait en termes du début du XXe siècle, a conduit à un résultat précis et valides. Il est devenu la base de la théorie de la radioactivité. Nous dégageons une entrée mathématique de la loi de désintégration radioactive.

– Soit N 0 – nombre d'atomes actifs dans le temps actif. Après l'intervalle de temps t sera nondecomposed N éléments.
– A un temps égal à la demi-vie restent exactement la moitié des éléments actifs: N = N 0/2.
– Après une nouvelle période d'une moitié de l'échantillon sont: N = N = N 0/4 0/2 2 atomes actifs.
– Après un temps égal à un autre demi-vie, l'échantillon ne retiendra que: N = N = N 0/8 0/2 Mars.
– Au moment où l'hôte n demi-périodes dans l'échantillon restera 0 N = N / 2 n des particules actives. Dans cette expression n = t / T½: le rapport de la sonde à la demi-vie.
– a spp expression mathématique quelque peu différente qui est plus pratique dans les tâches: N = N 0 2 – t / T½.
Le modèle permet de déterminer, en plus de la demi-vie, le nombre d'atomes d'isotopes actifs nondecomposed à un moment donné. Connaissant le nombre d'atomes de l'échantillon au début de l'observation, après un certain temps, vous pouvez déterminer la durée de vie du médicament.
Déterminer la demi-vie de la formule de la loi de désintégration radioactive, il aide que si certains paramètres: le nombre d'isotopes actifs dans l'échantillon, il est difficile de trouver assez.
Conséquences de la loi
formule de la fiche spp peut, en utilisant la notion d'activité de masse et les atomes de préparation.
L' activité est proportionnelle au nombre d'atomes radioactifs: A = A 0 • 2 -t / T. Dans cette formule, A 0 – activité de l' échantillon au temps zéro, A – activité après t secondes, T – demi-vie.
Poids de la substance peut être utilisée dans le motif: m = m 0 • 2 -t / T
Pour tous les intervalles réguliers pauses absolument la même proportion des atomes radioactifs disponibles dans cette préparation.
Les limites d'application de la loi
La loi à tous égards est une statistique, la définition des processus dans un microcosme. Il est entendu que la demi-vie des éléments radioactifs – statistique. La nature probabiliste des événements dans les noyaux atomiques suggère que le noyau arbitraire peut replier à tout moment. Prédire un événement est impossible, nous ne pouvons déterminer sa crédibilité à la fois. En conséquence, la demi-vie n'a pas de sens:
- pour un atome donné;
- masses minimales d'échantillon.
La durée de vie de l'atome

L'existence de l'atome dans son état d'origine peut durer une seconde, et peut-être des millions d'années. Parlez du temps des particules de la vie est pas nécessaire. En entrant un montant égal à la valeur moyenne de la durée de vie des atomes, vous pouvez parler de l'existence d'atomes d'un isotope radioactif, les effets de la désintégration radioactive. La demi-vie du noyau atomique dépend des propriétés de l'atome et ne dépend pas d'autres quantités.
Est-il possible de résoudre le problème: comment trouver la demi-vie, connaître la durée de vie moyenne?
Pour déterminer la formule de communication demi-vie pour la durée de vie moyenne de l'atome et l'aide constante de décroissance, pas moins.
τ = T 1/2 / LN2 = T 02/01 / 0693 = 1 / λ.
Dans ce dossier, τ – la durée de vie moyenne, λ – la constante de décroissance.
Utilisation de la demi-vie
Application spp pour déterminer l'âge des échantillons individuels est largement répandu dans la recherche de la fin du XXe siècle. La précision de la détermination de l'âge des artefacts fossiles est donc augmentée qui peut donner un aperçu de la durée de vie du millénaire avant JC.
Radiocarbone échantillons organiques fossiles sur la base du changement de l' activité du carbone-14 (radiocarbon) présent dans tous les organismes. Il tombe dans un corps vivant au cours du métabolisme et y est contenu à une concentration particulière. Après la mort du métabolisme avec l'environnement cesse. La concentration de carbone radioactif tombe à cause de la décomposition naturelle, l'activité diminue proportionnellement.
Avec de telles valeurs, la demi-vie, la formule de la loi de désintégration radioactive permet de déterminer le moment de la fin de vie de l'organisme.
Chaîne de transformations radioactives

Des études de radioactivité ont été réalisées dans des conditions de laboratoire. capacité étonnante à des éléments radioactifs restent actifs pendant des heures, des jours, voire des années ne pouvait pas venir comme une surprise au début des physiciens du XXe siècle. Des études, par exemple, le thorium, suivi d'un résultat inattendu: dans une ampoule fermée de son activité était importante. Au moindre relent de sa chute. La conclusion est simple: la conversion du thorium accompagné de la libération du radon (gaz). Tous les éléments de la radioactivité transformés en une substance totalement différente, et dans lequel les propriétés physiques et chimiques. Cette substance, à son tour, est aussi instable. Il est maintenant connu trois rangées de transformations similaires.
La connaissance de ces transformations sont extrêmement importantes pour déterminer le temps des zones contaminées dans le inaccessibilité processus de recherche atomique et nucléaire, ou des catastrophes. La demi-vie du plutonium – en fonction de ses isotopes – dans la plage de 86 s (PU) 238 à 80 Ma (Pu 244). La concentration de chaque isotope donne une idée sur la période de la zone de décontamination.
Le métal le plus cher
On sait que dans les temps modernes, il y a un métal beaucoup plus cher que l'or, l'argent et le platine. Ceux-ci comprennent le plutonium. Fait intéressant, dans la nature créée dans l'évolution du plutonium est introuvable. La plupart des éléments sont obtenus dans des conditions de laboratoire. Le fonctionnement du plutonium-239 dans les réacteurs nucléaires lui a permis de devenir extrêmement populaire ces jours. L'obtention suffisante pour une utilisation dans les réacteurs de la quantité de l'isotope rend pratiquement inestimable.

Plutonium-239 est obtenu in vivo à la suite de réactions en chaîne dans l'uranium-239 neptunium-239 (demi-vie – 56 heures). chaîne similaire permet d'accumuler du plutonium dans les réacteurs nucléaires. Le taux d'occurrence du nombre requis dépasse les milliards naturelles de fois.
Application dans l'énergie
On parle beaucoup sur les inconvénients de l'énergie nucléaire et la « bizarrerie » de l'humanité que presque toute ouverture est utilisé pour tuer leur propre genre. Ouverture du plutonium-239, qui est en mesure de participer à la réaction nucléaire en chaîne est autorisée à l'utiliser comme source d'énergie pacifique. L' uranium-235 est un analogue du plutonium trouvé dans le monde est extrêmement rare, sélectionnez – le à partir du minerai d'uranium est beaucoup plus difficile que d'obtenir du plutonium.
L'âge de la Terre
analyse des radio-isotopes d'isotopes d'éléments radioactifs donne une idée plus précise de la durée de vie d'un échantillon particulier.
En utilisant la chaîne de transformation « de l'uranium – thorium », contenue dans la croûte terrestre, permet de déterminer l'âge de notre planète. Le pourcentage de ces éléments en moyenne tout au long de la croûte sous-tend cette méthode. Selon les dernières données, l'âge de la Terre a 4,6 milliards d'années.