Réaction: exemples et formule
réaction d'échange, la substitution, les composés de décomposition sont discutés dans le programme du cours. Nous analysons les caractéristiques de chaque type présente des interactions exemples.
la définition
Quelle est la réaction du composé, dont des exemples sont dans les établissements d'enseignement est considéré comme la première étape de la formation? Pour commencer, nous notons que le terme « réaction chimique » en chimie est considéré comme le deuxième plus important.
Dans notre monde, la réaction de connexion se déroule chaque minute, quelles équations nous sont familières, mais nous sommes d'entre eux ne pense même pas.
Par exemple, la préparation de boissons gazeuses, la combustion du bois de chauffage – exemples typiques des réactions composés.
Ce procédé consiste à obtenir des produits ayant une certaine composition qualitative et quantitative des produits chimiques de départ.
Les signes de réactions chimiques
Tout processus, y compris la réaction chimique du composé accompagné de certains signes:
- l'émission de lumière ou de la chaleur;
- changer la couleur de la solution;
- sélection d'une substance gazeuse;
- apparence odeur particulière;
- la dissolution ou la précipitation.
Conditions de réaction
En fonction des caractéristiques de la composition qualitative et quantitative des composés chimiques de la réaction peut se dérouler à des conditions différentes.
Par exemple, le type d'interaction 2CA + O 2 = 2CaO (chaux vive) procède sans chauffage, suivi par la libération d'une quantité importante d'énergie thermique.
Comment la connexion des composants réaction? Les équations de ces processus impliquent l'écriture gauche des matières premières, et le côté droit est composé du produit de réaction.
4Na + O 2 = 2Na 2 O
De tels processus sont inhérents aux substances organiques. Ainsi, la réponse qualitative à l'insaturation (la présence de liaisons multiples) est le matériau de départ de la réaction d'oxydation du permanganate de potassium.

La combustion du bois
Ce processus se déroule selon l'équation:
C + O 2 = CO 2
Ceci est une réaction typique du composé, dont des exemples ont déjà été donnés ci-dessus. Quelle est l'essence de ce processus? En faisant réagir le bois avec l'oxygène de l'air, la formation de molécules de dioxyde de carbone. Le processus est accompagné par la formation de nouvelles molécules de liaison de communication complexe est une réaction exothermique.
La connexion peut entre les substances complexes réagir? Des exemples d'interaction avec des substances simples ont été discutées ci-dessus, mais ce type de caractéristique de substances complexes. Un mode de réalisation typique de cette interaction peut être considéré comme la réaction d'extinction.
CaO + H2O = Ca (OH) 2
Ce processus est également accompagnée d'une quantité importante d'énergie thermique. Parmi les caractéristiques spécifiques de ce processus, nous notons sa spontanéité.
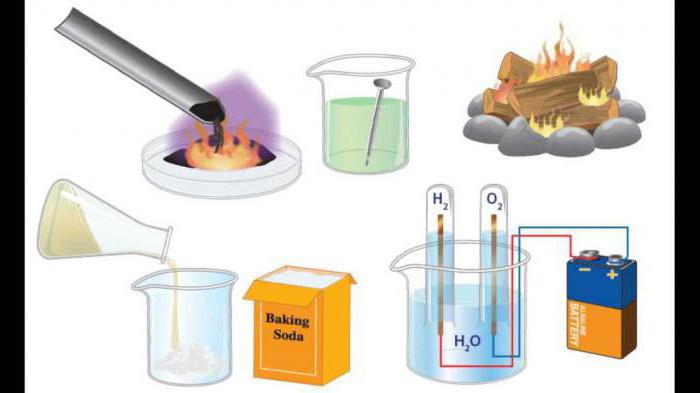
classification
Selon la composition des matières de départ et les produits de réaction de composés libérés réaction, la décomposition, l'échange de substitution. Tenez compte de ses exemples, ainsi que la définition de ces processus.
Remplacement de – une pièce de rechange atomes substance simple composé complexe.
Connexion – un processus de combinaison de plusieurs substances simples ou complexes en plus complexe. Des exemples de ces processus peuvent résulter de la chimie inorganique et organique.
2H 2 + O 2 = 2H 2 O
Ce processus se produit avec la libération d'une quantité importante de chaleur, de sorte que l'explosion est possible.
C 2 H 4 + H 2 = C 2 H 6
Lors du passage d'éthylène à travers l'atome d'hydrogène, il y a une rupture de la double liaison, la formation de la limite (saturé) hydrocarbure.
La décomposition – sont les réactions chimiques qui produisent plus de substances ayant une composition qualitative et quantitative simple d'un composé complexe.
Les réactions d' échange d' ions et – ce sont des processus qui se produisent complexe entre les substances qui donnent lieu à l'échange d'éléments constitutifs.
Il y a trois conditions d'écoulement du processus: dégagement de gaz, les précipitations, la formation substance malodissotsiiruemogo.
Cette réaction est appelée estérification, comme le produit final de réaction est un ester. Les conditions de traitement dans la direction vers l'avant est l'introduction dans le mélange réactionnel de l'acide sulfurique concentré.
La division de l'état d'agrégation de substances interagissant
Tous les processus chimiques sont classés sur la base sur l' interopérabilité homogène et hétérogène. Dans le premier cas, les matières de départ et les produits de réaction sont dans un état d'agrégation, et on les laisse à l'état espèces hétérogènes différent.
Par exemple, un processus homogène sera la réaction suivante:
H 2 (g) + Cl 2 (g) = 2 HCl (gaz)
Comme réaction hétérogène peut considérer le scénario suivant:
CaO (tv) + H 2 O (g) = Ca (OH) 2 (aq)

De la modification de l'état d'oxydation
La réaction d'un composé dont la formule a été donnée ci-dessus (formation d'eau à partir de substances simples) est un processus d'oxydo-réduction. L'essence du processus réside dans le fait qu'il y ait acceptation et le retour des électrons.
Parmi les composés de la réaction il y a également des procédés qui ne sont pas accompagnés par un changement d'état d'oxydation, à savoir ne sont pas OVR:
CaO + H2O = Ca (OH) 2
Par la nature du flux
Selon que le procédé peut se dérouler dans la direction vers l'avant ou la réaction a lieu dans le sens inverse, en chimie isolé interaction irréversible et réversible.
Par exemple, la réaction qualitative de composés organiques est irréversible, car elle conduit à la formation de substance insoluble ou gazeux. Un exemple d'une telle réaction est la qualité de l'interaction du « miroir d'argent », qui est un procédé de détermination qualitative dans un mélange d'aldéhydes.
D'autres exemples de réalisation de réactions réversibles qui peuvent se dérouler dans deux directions mutuellement opposées, noter la réaction d'estérification:
CO 2 + H 2 O = H 2 CO 3
Sur l'utilisation d'un catalyseur
Dans certains cas, un accélérateur (catalyseur) doit être utilisé pour aller procédé chimique. Un exemple est l'interaction entre le processus de décomposition catalytique de peroxyde d'hydrogène.

Caractéristiques d'analyse syntaxique OVR
Parmi les questions qui conduisent le plus souvent à des difficultés chez les enfants de l'école est le placement des coefficients dans la réaction en utilisant une méthode de balance électronique. Pour commencer, il y a certaines règles selon lesquelles nous pouvons déterminer le degré d'oxydation dans les éléments individuels dans chaque substance.
Peu importe si la substance simple ou complexe à traiter, le montant de celle-ci est égale à zéro.
L'étape suivante consiste à sélectionner les substances chimiques particulières ou des éléments qui ont changé la valeur du degré d'oxydation. Ils sont déchargés séparément, montrant les signes « plus » ou « moins » le nombre d'électrons reçus ou faire des dons.
Entre ces chiffres sont le plus petit nombre, qui, lorsqu'il est divisé par le nombre d'électrons reçus et fonte seront entiers préparés.
Ces chiffres sont des coefficients stéréochimiques, dans l'équation processus organise proposée. Une étape importante dans l'analyse de la réaction d'oxydo-réduction consiste à déterminer un oxydant et réducteur, et l'enregistrement des processus. Comme l'agent réducteur est choisi ces atomes ou d'ions, qui, au cours de son interaction accrue degré d'oxydation, l'oxydant, par contre, la réduction du paramètre caractéristique.
Est-ce que cet algorithme suggère, quelques changements Organic Chemistry? La réaction d'un composé de substitution flux de décomposition pour changer d'état d'oxydation, est considéré comme un algorithme similaire.
Il y a certaines fonctionnalités de l'agencement des degrés d'oxydation de composés organiques, mais aussi leur somme doit être égale à zéro.
Selon la façon dont il change l'oxydation, identifier plusieurs types de réactions chimiques:
- dismutation – en raison d'un changement dans les états d'oxydation d'un seul et même élément dans le côté grand et plus petit;
- kontrproportsionirovanie – consiste à faire réagir l'agent réducteur et l'agent oxydant, dans laquelle composition le même élément, mais à différents niveaux d'oxydation.
conclusion
En tant que petite conclusion, nous notons que l'interaction des substances entre elles se produisent les changements, transformations. La réaction chimique est la conversion d'un ou plusieurs corps réactionnels en produits ayant différentes compositions qualitatives et quantitatives.
Si les transformations nucléaires observées changement dans la composition des noyaux atomiques, dans le cas de réactions chimiques qui non seulement il y a une redistribution des noyaux et des électrons, ce qui conduit à l'apparition de nouveaux composés.
Les processus peuvent être accompagnés par la libération de la lumière, la chaleur, l'apparition de l'odeur, la précipitation, la formation de substances gazeuses.
Il existe de nombreuses options pour la classification des interactions organiques et inorganiques sur différents motifs. Parmi les plus courants pour ce changement peut citer l'oxydation, l'état d'agrégation, la réversibilité de l'écoulement, le mécanisme de ce processus, l'utilisation du catalyseur (inhibiteur).
Les réactions chimiques sont à la base non seulement de la production industrielle, mais aussi la base de la vie. Sans processus métaboliques qui ont lieu dans les organismes vivants dont l'existence serait impossible.