L'une des définitions de la vie est la suivante: « La vie est le mode d'existence des corps protéiques. » Sur notre planète, sans exception organismes contiennent ces matières organiques, comme les protéines. Cet article décrit les protéines simples et complexes différences identifiées dans la structure moléculaire, et discute de leurs fonctions dans la cellule.
Quelles sont les protéines
Du point de vue de la biochimie – un des polymères organiques de haut poids moléculaire, des monomères qui sont 20 types d'acides aminés différents. Ils sont reliés entre eux par des liaisons chimiques covalentes, peptide autrement connu. Etant donné que les monomères de protéine sont des composés amphotères, ils contiennent à la fois un groupe amino et un groupe fonctionnel carboxyle. liaison chimique CO-NH se produit entre eux.
Si le polypeptide est constitué de liaisons de résidus d'acides aminés, il forme une protéine simple. Les molécules de polymère, comprenant en outre des ions métalliques, des vitamines, des nucléotides, des hydrates de carbone – sont des protéines complexes. Nous examinons ensuite la structure spatiale des polypeptides.
Les niveaux d'organisation des molécules de protéines
Ils sont présentés dans quatre configurations différentes. La première structure – linéaire, il est le plus simple et a la forme d'une chaîne polypeptidique lors de sa spirale de la formation de liaisons hydrogène supplémentaires. Ils stabilisent l'hélice, qui est appelée une structure secondaire. Les institutions tertiaires ont des protéines simples et complexes, la majorité des cellules végétales et animales. La dernière configuration – quaternaire se pose dans l'interaction de plusieurs molécules de la structure native, coenzymes Unies, à savoir ces protéines ont une structure complexe, fonctionnent dans diverses fonctions du corps.
Une variété de protéines simples
Ce groupe n'est pas de nombreux polypeptides. Les molécules sont constituées uniquement de résidus d'acides aminés. Pour inclure des protéines, telles que histones et globulines. Le premier représentés dans la structure de noyau, et sont combinés avec les molécules d'ADN. Le deuxième groupe – globulines – sont les principaux composants du plasma sanguin. Une telle protéine telle que la gamma-globuline, remplit les fonctions de la défense immunitaire et est un anticorps. Ces composés peuvent former des complexes, qui contiennent des hydrates de carbone complexes et des protéines. De telles protéines simples fibrillaires comme le collagène et l'élastine, font partie du tissu conjonctif, du cartilage, des tendons, de la peau. Leur fonction principale – la construction et de soutien.
la protéine tubuline est membre de microtubules, qui sont des composants d'organismes unicellulaires et flagelles tels cilia que ciliés, Euglena, flagellés parasites. Cette même protéine est membre d'organismes multicellulaires (flagelles de spermatozoïdes, ovules ciliaires, l'épithélium ciliaire de l'intestin grêle).
albumine sert à stocker une fonction (par exemple, une protéine d'œufs de poule). Dans l'endosperme des graines de céréales – seigle, riz, blé – molécules de protéines accumulent. Ils sont appelés inclusions cellulaires. Ces substances sont utilisées dans l'embryon de la graine au début de son développement. De plus, la teneur élevée en protéines du charançon du blé est un indicateur très important de la qualité de la farine. Pain de farine de gluten riche a une haute qualité de saveur et plus utile. Gluten contiennent ce qu'on appelle le blé dur. Le plasma sanguin poissons d'eau profonde contient des protéines qui empêchent la mort du froid. Ils possèdent les propriétés antigel, ce qui empêche la mort de l'organisme à des températures basses eaux. D'autre part, dans la composition de la paroi cellulaire des bactéries thermophiles dans les sources géothermiques contenue protéines capables de conserver sa configuration naturelle (structure tertiaire ou quaternaire) et ne dénature pas à des températures allant de 50 à + 90 ° C.
proteid
Ce sont des protéines complexes, qui sont caractérisés par une grande diversité en ce qui concerne les différentes fonctions réalisées par eux. Comme indiqué précédemment, le groupe des polypeptides, à l'exception de la partie de protéine contient un groupement prosthétique. Sous l'influence de divers facteurs tels que la température élevée, les sels de métaux lourds, concentré de protéines de complexes alcalins et acides peuvent modifier sa forme spatiale, la simplifiant. Ce phénomène est appelé dénaturation. La structure des protéines complexes est perturbée liaisons hydrogène sont rompues et les molécules perdent leurs propriétés et fonctions. En règle générale, la dénaturation est irréversible. Mais certains des polypeptides agissent comme un catalyseur, la conduite et les fonctions de signalisation, il est possible renaturation – restaurer la structure naturelle des protéides.

Si l'action est un facteur de déstabilisation va depuis longtemps, la molécule de protéine est complètement détruite. Cela conduit à la rupture des liaisons peptidiques de la structure primaire. Restaurer la protéine et sa fonction ne soit plus possible. Ce phénomène est appelé la destruction. Un exemple est la cuisson des oeufs: protéine liquide – albumine, située dans la structure tertiaire est complètement détruite.
biosynthèse des protéines
Encore une fois, rappelons que dans les polypeptides des organismes vivants est constitué de 20 acides aminés, dont certains sont irremplaçables. Cette lysine, méthionine, phénylalanine, et ainsi de suite. D. Ils entrent dans la circulation sanguine de l'intestin grêle après scindant produits protéiques. Pour synthétiser les acides aminés essentiels (alanine, la proline, la sérine), les champignons et les animaux utilisent des composés contenant de l'azote. Les plantes, étant autotrophe, forment indépendamment un des monomères constitutifs nécessaires qui représentent des protéines complexes. Pour cette réaction d'assimilation ils sont les nitrates utilisés, l'ammoniac, ou exempt d'azote. Dans certains types de micro-organismes se doter d'un ensemble complet d'acide aminé, alors que dans d'autres seulement quelques-uns sont des monomères synthétisés. Les étapes de la biosynthèse des protéines se produisent dans les cellules de tous les organismes vivants. Au cœur de la transcription se produit, et dans le cytoplasme de la cellule – diffusion.
La première étape – la synthèse du précurseur de l'ARNm produit par l'ARN polymérase de l'enzyme. Il brise les liaisons hydrogène entre les chaînes d'ADN, et l'un d'entre eux sur le principe de complémentarité recueille molécule pré-ARNm. Il est exposé à slaysingu qui est mûr, puis sort du noyau vers le cytoplasme, formant l'acide ribonucléique messager.
Pour mettre en œuvre la deuxième étape nécessite une organites spécifique – ribosomes et des informations moléculaires et le transfert des acides ribonucléiques. Une autre condition importante est la présence d'ATP, comme les réactions du métabolisme plastique, qui appartient à la biosynthèse des protéines se produit avec absorption d'énergie.
Les enzymes, leur structure et leur fonction
Ceci est un grand groupe de protéines (environ 2000), jouant le rôle des substances qui affectent la vitesse des réactions biochimiques dans les cellules. Ils peuvent être simples (trepsin, pepsine) ou complexe. protéines complexes composées de apoenzyme et. Coenzyme La spécificité de la protéine par rapport aux composés pour lesquels elle agit, détermine une coenzyme, et l'activité des protéides est observée uniquement dans le cas où le composant de protéine liée à l'apoenzyme. L'activité catalytique de l'enzyme est indépendante de la molécule, mais seulement par le centre actif. Sa structure correspond à la structure chimique des substances catalysées par le principe de la « serrure à clé », de sorte que l'action des enzymes est strictement spécifique. Les fonctions des protéines complexes sont en participation dans les processus métaboliques et les utiliser comme accepteurs.
Les classes de protéines complexes
Ils ont été développés par des biochimistes, basé sur 3 critères: propriétés physico-chimiques, les caractéristiques et la spécificité des caractéristiques structurelles. Le premier groupe comprend les polypeptides de propriétés électrochimiques différentes. Ils sont divisés en base, neutre et acide. Par rapport aux protéines d'eau peuvent être hydrophiles, amphiphiles et hydrophobe. Le deuxième groupe d'enzymes qui ont été considérées comme précédemment. Le troisième groupe comprend les polypeptides qui diffèrent dans le groupe prosthétique est la composition chimique (chromoproteids, les nucléoprotéines, les métalloprotéines).
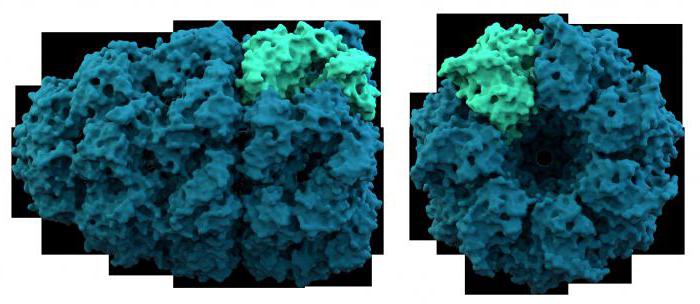
Tenir compte des propriétés des protéines complexes plus en détail. Ainsi, par exemple, la protéine acide qui fait partie de ribosomes, contient 120 acides aminés et est polyvalent. Il est situé dans les organites-synthèse des protéines, les cellules procaryotes et eucaryotes. Un autre membre de ce groupe – protéine S-100, se compose de deux chaînes liées ion calcium. Il est membre des neurones et des cellules gliales – tissu de soutien du système nerveux. La propriété commune de tous protéine acide – une teneur élevée en acides dicarboxyliques: glutamique et aspartique. Par protéines alcalines comprennent les histones – protéines qui composent les acides nucléiques ARN et ADN. La particularité de la composition chimique est la grande quantité de lysine et de l'arginine. Histones, ainsi que la forme de chromosome chromatine nucléaire – structure cellulaire critique l'hérédité. Ces protéines sont impliquées dans les processus de transcription et de traduction. protéines amphiphiles largement représentées dans les membranes cellulaires, formant une double couche de lipoprotéines. Ainsi, le groupe a étudié les protéines complexes discutées ci-dessus, nous étions convaincus que leurs propriétés physico-chimiques en raison de la structure du composant des protéines et des groupes prosthétiques.
Certaines protéines de la membrane cellulaire complexes sont capables de reconnaître une variété de composés chimiques, tels que des antigènes et réagir. Cette fonction de signalisation protéides, il est très important pour les procédés d'absorption sélective, des substances de l'environnement extérieur et de le protéger.
Et protéoglycanes Glycoprotéines
Ce sont des protéines complexes qui diffèrent entre une composition biochimique des groupes prosthétiques. Si les liaisons chimiques entre le composant protéique et la partie hydrate de carbone – de façon covalente glycosides, ces substances sont appelées glycoprotéines. Apoenzyme ils ont présenté des molécules de mono- et oligosaccharides, des exemples de telles protéines sont la prothrombine, le fibrinogène (protéines impliquées dans la coagulation du sang). hormones gonadotropes et Kortiko-, des interférons, des enzymes et de la membrane sont des glycoprotéines. Dans les molécules de protéine protéoglycane partie est seulement 5%, le reste étant un groupe prosthétique (de geteropolitsaharid). Les deux parties sont reliées par une liaison glycosidique des groupes groupes OH-thréonine et l'arginine et NH₂-glutamine, et de la lysine. molécules protéoglycanes jouent un rôle très important dans les cellules du métabolisme de sel de l'eau. Ci-dessous un tableau de protéines complexes, nous avons étudié.
| glycoprotéines | protéoglycanes |
| Les composants structuraux des groupes prothétiques | |
| 1. monosaccharides (glucose, galactose, mannose) | 1. Acide Hyaluronique |
| 2. oligosaccharides (maltose, lactose, saccharose) | 2. acide chondroïtine. |
| 3. Les dérivés aminés acétylés de monosaccharides | 3. héparine |
| 4. Dezoksisaharidy | |
| 5. acide neuraminique et sialique | |
métalloprotéines
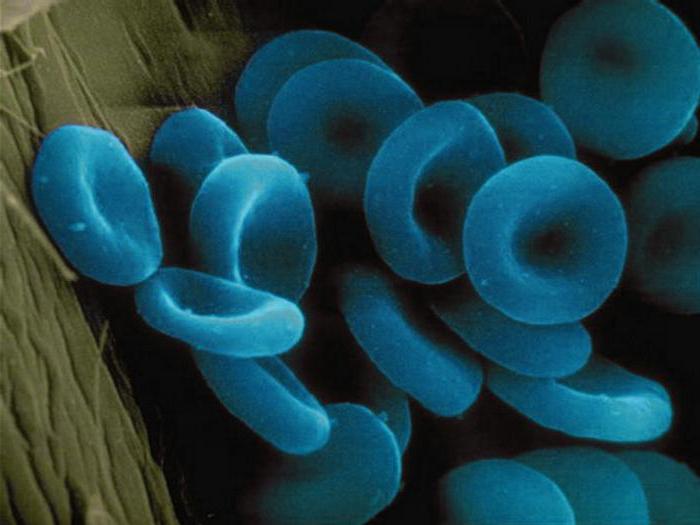
Ces matières contiennent en tant que partie de son ion moléculaire d'un ou plusieurs métaux. Considérons des exemples de protéines complexes appartenant au groupe ci-dessus. Il est au-dessus de toutes les enzymes telles que la cytochrome oxydase. Il est situé sur la cristae des mitochondries et active la synthèse de l' ATP. Ferrin et la transferrine – protéique contenant des ions de fer. dépôts Origine eux dans les cellules, et le second est le transport de protéines du sang. Un autre métalloprotéines – alfaamelaza qu'il contient des ions calcium est comprise dans la composition de la salive et du suc pancréatique, en participant à la décomposition de l' amidon. Hémoglobine est comment métalloprotéines et hromoproteidov. Il sert une protéine de transport qui transporte l'oxygène. Le résultat est un composé de l'oxyhémoglobine. L'inhalation de monoxyde de carbone, ou appelé monoxyde de carbone, les molécules d'hémoglobine des erythrocytes former des composés très stables. Il se propage rapidement aux organes et tissus, provoquant une intoxication cellulaire. En conséquence, après inhalation prolongée de la mort de monoxyde de carbone se produit par asphyxie. L'hémoglobine transporte partiellement et le dioxyde de carbone formé dans les processus cataboliques. À partir du flux sanguin de dioxyde de carbone dans les poumons et les reins, et d'eux – à l'environnement extérieur. Certains crustacés et mollusques protéine de transport qui transporte l'oxygène, est le trou de serrure. Au lieu du fer qu'il contient des ions de cuivre, de sorte que le sang des animaux ne sont pas rouge et bleu.
fonction de la chlorophylle
Comme nous l'avons mentionné précédemment, les protéines complexes peuvent former des complexes avec des pigments colorés organiques – substances. Leur couleur dépend des groupes hromoformnyh qui absorbent sélectivement certains spectres de la lumière du soleil. Dans les cellules végétales a vert plastes – chloroplastes contenant des pigments de chlorophylle. Il est composé d'atomes de magnésium et un alcool polyhydrique, phytol. Ils sont associés à des molécules de protéines, et eux-mêmes contiennent des chloroplastes thylakoïdes (plaques) ou dans des piles membrane associés – facette. Ils sont des pigments photosynthétiques – chlorophylle – et caroténoïdes supplémentaires. Voici toutes les enzymes utilisées dans les réactions photosynthétiques. Ainsi chromoproteids, qui comprennent la chlorophylle, exercent des fonctions critiques dans le métabolisme, à savoir dans l'assimilation et dissimilation réactions.
protéines virales
Ils comprennent des représentants des formes non-cellulaires de la vie, entrer dans le royaume de Vir. Les virus ne disposent pas de leur propre appareil de synthèse des protéines. Les acides nucléiques, l'ADN ou de l'ARN, peuvent induire la synthèse de la plupart des particules propres cellules infectées par le virus. virus simples sont constitués uniquement de molécules de protéines, assemblées de manière compacte dans une structure hélicoïdale ou une forme polyédrique, comme le virus de la mosaïque du tabac. virus complexes ont une membrane supplémentaire faisant partie de la membrane plasmatique de la cellule hôte. Comme il peut inclure glycoprotéines (virus de l'hépatite B, le virus de la variole). La fonction principale des glycoprotéines – une reconnaissance des récepteurs spécifiques sur la membrane de la cellule hôte. La composition des membranes virales et des protéines supplémentaires comprennent des enzymes qui fournissent reduplication de l' ADN ou la transcription d'ARN. Sur la base de ce qui précède, on peut conclure ce qui suit: les protéines virales de particules coquilles ont une structure spécifique, en fonction des protéines de la membrane de la cellule hôte.
Dans cet article, nous avons donné les caractéristiques des protéines complexes, étudié leur structure et la fonction dans les cellules de divers organismes.










