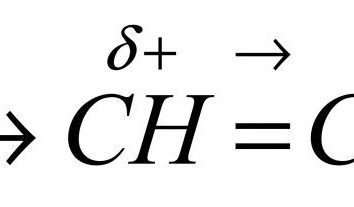L'essence de la réaction chimique. La loi de la conservation des substances de masse (produits chimiques)
Chimie – la science des substances, leur appareil, leurs propriétés et leurs transformations, on obtient à la suite de réactions chimiques, dans laquelle les fondations posées par les lois de la chimie. Tout chimie générale repose sur 4 lois fondamentales, dont beaucoup ont ouvert des scientifiques russes. Mais dans cet article, nous nous concentrerons sur la loi de conservation des substances de masse, qui fait partie des lois fondamentales de la chimie.
La loi de conservation de la masse de la matière discutée en détail. Dans l'article l'histoire de la découverte de la loi, son essence et les composants seront décrits.
La loi de la conservation des substances de masse (produits chimiques): le libellé
substances de masse entrant dans une réaction chimique est égale à la masse du matériau qui en résulte.

Mais revenons à l'histoire. Il y a plus de 20 siècles philosophe grec Démocrite suppose que toute la matière est des particules invisibles. веке химик английского происхождения Роберт Бойль выдвинул теорию: вся материя построена из мельчайших частиц вещества. Et que dans l'origine anglaise XVII siècle chimiste Robert Boyle a proposé la théorie: toute la matière est construit à partir des plus petites particules de matière. Boyle a mené des expériences avec le métal, le chauffage à la chaleur. Il a pesé les navires avant et après le chauffage, et a remarqué que le poids a augmenté. La combustion du bois a donné l'effet inverse – pesait moins de bois cendres.
histoire moderne
La loi de la conservation des substances de masse (produits chimiques) a accordé l'unification scientifique en 1748 MV Lomonosov, et en 1756, il a été témoin par eksperimentnym. scientifique russe preuve présentée. Si capsules thermosoudés pesaient capsules d'étain et de chauffage, et puis après, il est évident substances du droit de la conservation de la masse (produits chimiques). Le scientifique exprimé libellé Lomonosov, très semblable à la moderne. scientifique russe a apporté une contribution indéniable au développement de la théorie atomique moléculaire. Il a uni la loi de conservation des substances de masse (produits chimiques) à la loi de conservation de l'énergie. La doctrine actuelle a confirmé les condamnations. Seulement trente ans plus tard, en 1789, le savant Lavoisier de la France a confirmé la théorie Lomonosov. Mais ce n'était qu'une supposition. Loi, il était au XXe siècle (début), après 10 années de recherche par le scientifique allemand G. Landolt.

exemples d'expériences
Tenir compte des expériences qui peuvent prouver la loi de conservation des substances de masse (produits chimiques). Exemples:
- Le récipient a été placé le phosphore rouge, couvrir hermétiquement bouché et on le pèse. Chauffer à feu doux. La formation de fumée blanche (oxyde de phosphore) dit qu'il y avait une réaction chimique. Repesé et vérifiez que le poids du récipient avec la substance obtenue ne change pas. L'équation de la réaction: 4F + 3O2 = 2R2O3.
- Prenez deux navires Landolt. Dans l'un d'eux avec précaution afin de ne pas mélanger, verser des réactifs nitrate de plomb et de l'iodure de potassium. Dans un autre récipient mis thiocyanate de potassium et de chlorure ferrique. Était bien fermé. Le bac doit être équilibré. Mélanger le contenu de chaque récipient. Dans un précipité jaune a été formé – un iodure de plomb, thiocyanate obtenu dans un autre noir fer couleur rouge. Dans la formation de nouvelles substances échelles d'équilibre.
- Zazhzhom une bougie, et le mettre dans un récipient. Fermer hermétiquement le récipient. Voici les échelles en équilibre. Quand un air d'arrivée de conteneurs, la bougie sort, le processus de réaction chimique est terminée. Les balances sont équilibrées, de sorte que le poids des réactifs et le même poids de composés formés.
- Dessiner une plus grande expérience et de considérer l'exemple de la loi de conservation des substances de masse (produits chimiques). Formule chlorure de calcium – CaCl2, et de l'acide sulfate – H2SO4. Dans la réaction de ces substances, un précipité blanc – sulfate de calcium (CaSO4), et de l'acide chlorhydrique (HCl). Pour l'expérience, nous avons besoin de l'échelle et le navire Landolt. Très soigneusement versez dans un récipient de chlorure de calcium et de sulfate acide, sans les mélanger, hermétiquement. Nous pesons dans la balance. Puis mélanger les réactifs, et en observant que le précipité blanc (sulfate de calcium). Cela montre qu'il y avait une réaction chimique. Encore une fois navire de pesée. Le poids est resté le même. ressemblerait l'équation de cette réaction suivante: CaCl2 + H2SO4 = CaSO4 + 2HCl.

principal
L'objectif principal des réactions chimiques qui se décomposent les molécules dans les mêmes substances et former ensuite de nouvelles molécules de la substance. Dans ce cas, le nombre d'atomes de chaque substance à l'interaction et reste inchangé après. Lorsque la formation de nouvelles substances, l'énergie est libérée, et quand ils se décomposent à son absorption, l'effet dynamique présente, qui se manifeste sous la forme de l'absorption ou de la libération de chaleur. Au cours de la réaction chimique des précurseurs de molécules – des réactifs séparés en atomes qui sont ensuite obtenus par des produits de la réaction chimique. Atomes eux-mêmes restent inchangés.

La réaction peut durer pendant des siècles, et peut se produire rapidement. Dans la fabrication de produits chimiques nécessaires pour connaître le taux d'apparition d'une réaction chimique particulière, l'absorption ou la libérer passe la température qui est la pression nécessaire, la quantité de réactifs et de catalyseurs. Les catalyseurs – petite substance de poids, ne participe pas à la réaction chimique, mais affecter de manière significative sa vitesse.
Comment écrire l'équation chimique

La connaissance de la loi de conservation des substances de masse (produits chimiques), il est possible de comprendre comment faire des équations chimiques.
- Nous avons besoin de connaître la formule des réactifs entrant dans une réaction chimique et des produits de formule obtenus dans le résultat.
- De gauche réactifs de formule écrite, entre lesquels est placé le « + » et le droit – la formule du produit résultant avec le signe « + » entre ceux-ci. Dans les formules des réactifs et le produit obtenu est placé signe « = » ou flèche.
- Le nombre d'atomes de tous les composants des réactifs doit être égal au nombre d'atomes de produits. Par conséquent, les coefficients sont calculés, qui sont mis en avant des formules.
- Ne déplacez pas les formules du côté gauche de l'équation à droite ou à les réorganiser.
La valeur de la loi
La loi de la conservation des substances de masse (produits chimiques) a permis de développer un sujet intéressant en tant que science. Découvrez pourquoi.
- Une grande importance de la loi de conservation de masse dans les substances chimiques qui, sur la base de sa composition chimique des calculs pour l'industrie. Supposons que vous voulez obtenir un 9 kg de sulfure de cuivre. On sait que la réaction de cuivre et de soufre a lieu à un rapport pondéral de 2: 1. Selon cette loi, la réaction chimique du poids de cuivre de 1 kg et 2 kg de soufre, on obtient le sulfure de cuivre pesant 3 kg. Comme nous avons besoin pour obtenir le poids de sulfure de cuivre de 9 kg, soit 3 fois plus, et les réactifs ont besoin de 3 fois plus. Soit 6 kg de cuivre et 3 kg de soufre.
- Possibilité de faire l'équation chimique correcte.
conclusion

Après avoir lu cet article ne devrait pas avoir des questions sur l'essence de la loi de l'histoire de sa découverte, à laquelle, soit dit en passant, notre célèbre compatriote impliqué, scientifique MV Lomonosov. Ce qui confirme encore une fois à quel point est la puissance de la science otchestvennoy. Il est également devenu clair signification de la découverte de cette loi et sa signification. Et ceux qui ne savaient pas comment écrire des équations chimiques à l'école, après avoir lu l'article, doivent apprendre ou de se rappeler comment le faire.