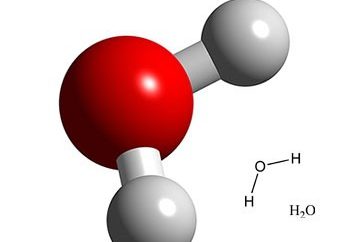
Qu'est-ce que l'oxygène? composés oxygénés
L'oxygène (O) – élément chimique non métallique du groupe 16 (VIa) du Tableau Périodique. Il est un gaz incolore, insipide et inodore nécessaire pour les organismes vivants – animaux qui convertissent en dioxyde de carbone, et les plantes qui utilisent le CO 2 comme source de carbone, et O 2 est renvoyé dans l'atmosphère. L'oxygène forme un composé réagissant avec pratiquement tout autre élément, et déplace les éléments chimiques de la communication avec l'autre. Dans de nombreux cas, ces processus sont accompagnés par la libération de la chaleur et de la lumière. Le composé le plus important de l'oxygène est l'eau.

Histoire de la découverte
En 1772, le chimiste suédois Carl Wilhelm Scheele d' abord démontré que cet oxygène réception par le nitrate de chauffage de l' oxyde de potassium, le mercure, ainsi que de nombreuses autres substances. Indépendamment de lui en 1774, le chimiste anglais Dzhozef Pristli découvert l'élément chimique par décomposition thermique de l'oxyde de mercure et a publié ses conclusions dans la même année, trois ans avant la publication Scheele. Dans les années 1775-1780 le chimiste français Antuan Lavuaze a interprété le rôle de l'oxygène dans le souffle et la combustion, en rejetant la théorie phlogistique, communément admise à l'époque. Il est noté pour sa tendance à former des acides lorsqu'ils sont combinés avec diverses substances et appelé élément OXYGÈNE, qui signifie en grec « acide généré ».

prévalence
Qu'est-ce que l'oxygène? Comptabilité de 46% en poids de la croûte, il est l'élément le plus commun de celui-ci. La quantité d'oxygène dans l'atmosphère est de 21% en volume et le poids de ses 89% dans l'eau de mer.
Dans l'élément de roches combiné avec les métaux et non-métaux tels que les oxydes qui sont acides (par exemple, le soufre, le carbone, l'aluminium et le phosphore) ou de base (calcium, magnésium et fer) et en tant que composés de type sel qui peut être considéré comme formé à partir de l'acide et des oxydes basiques tels que les sulfates, les carbonates, les silicates, les phosphates et les aluminates. Même si elles sont nombreuses, mais ces solides ne peuvent servir de sources d'oxygène, en tant que clivage de la liaison avec l' élément métallique atomes consommation d'énergie aussi.
traits
Si la température de l'oxygène en dessous de -183 ° C, il devient liquide bleu pâle, et à -218 ° C – solide. O 2 pur est 1,1 fois plus lourd que l' air.
Pendant la respiration et les animaux certaines bactéries consomment de l'oxygène de l'atmosphère et le dioxyde de carbone recyclé, alors que dans la photosynthèse des plantes vertes en présence de la lumière solaire absorber le dioxyde de carbone et libérer l'oxygène libre. Presque tout O 2 dans l'atmosphère est produite par la photosynthèse.
A 20 ° C pendant environ 3 parties en volume d'oxygène dissous dans 100 parties d'eau douce, un peu moins que – dans l'eau de mer. Il est nécessaire pour la respiration des poissons et autres animaux marins.
oxygène naturel est un mélange de trois isotopes stables 16 O (99.759%), les 17 O (0.037%) et 18 O (0204%). Il existe plusieurs isotopes radioactifs produits artificiellement. La plupart d'entre eux sont est 15 O (demi-vie 124) longue durée de vie qui est utilisé pour étudier la respiration chez les mammifères.

allotrope
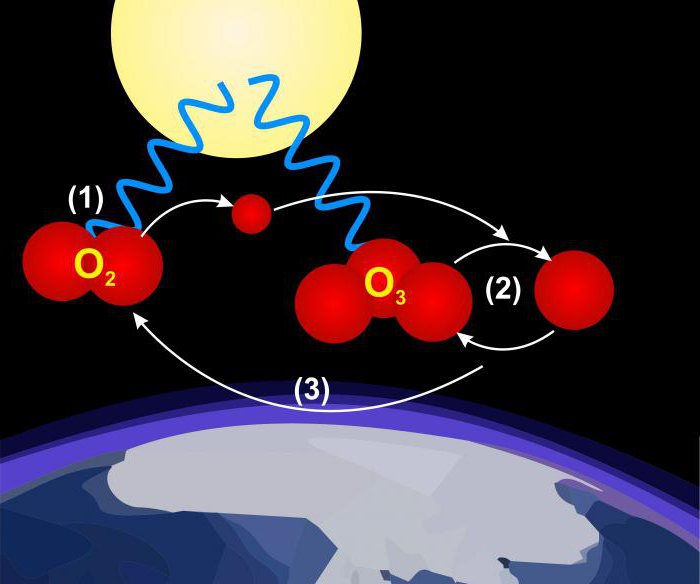
Une idée plus claire de ce que l' oxygène, permet d'obtenir ses deux formes allotropiques, diatomique (O 2) et triatomic (O 3, la couche d' ozone). Propriétés de forme diatomique suggèrent que les six électrons se lient atomes de carbone et deux restent non apparié, ce qui provoque le paramagnétisme de l'oxygène. Trois molécules d'ozone d'atomes ne sont pas situés sur une ligne droite.
L' ozone peut être produit conformément à l'équation: 3O 2 → 2O 3.
Le processus est endothermique (nécessite de l'énergie); transformation de l'ozone en oxygène diatomique contribue à la présence de métaux de transition ou de leurs oxydes. L'oxygène pur est transformé en ozone par l'action d'une décharge luminescente électrique. La réaction se produit également lors de l'absorption de lumière ultraviolette avec une longueur d'onde d'environ 250 nm. L'apparition de ce processus dans l'atmosphère supérieure élimine le rayonnement qui serait préjudiciable à la vie à la surface de la Terre. odeur âcre de l'ozone est présent à l'intérieur d'une étincelle d'équipements électriques tels que des générateurs. Ce gaz est bleu clair. Sa densité à 1,658 fois plus grande que l'air, et présente un point d'ébullition de -112 ° C à la pression atmosphérique.
oxydant fort capable de convertir – Ozone dioxyde de soufre, le trioxyde, le sulfure en sulfate, iodure, iode (méthode d' analyse pour fournir son évaluation), ainsi que de nombreux dérivés de composés organiques contenant de l' oxygène tels que des aldéhydes et des acides. La conversion des hydrocarbures avec de l'ozone à partir de gaz d'échappement d'automobile dans ces acides et des aldéhydes est la cause du smog. Dans l'industrie, l'ozone est utilisé comme réactif chimique, désinfectant pour le traitement des eaux usées, épuration de l'eau et le blanchiment des tissus.
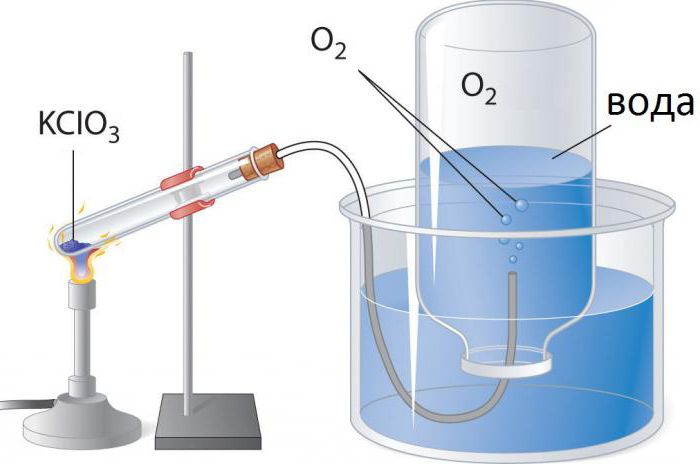
méthodes de préparation
Procédé de production d'oxygène dépend de la quantité de gaz est nécessaire pour recevoir. Les méthodes de laboratoire pour les éléments suivants:
1. La décomposition thermique de certains sels tels que le chlorate de potassium ou le nitrate de potassium:
- 2KClO 3 → 2KCl + 3O 2.
- 2KNO 3 → 2KNO 2 + O 2.
la décomposition de chlorate de potassium catalysée par des oxydes de métaux de transition. Pour ce dioxyde de manganèse souvent utilisé (pyrolusite, MnO2). Le catalyseur abaisse la température requise pour le dégagement d'oxygène de 400 à 250 ° C
2. La dégradation des oxydes métalliques sous l'action de la température:
- 2HgO → 2Hg + O 2.
- 2AG 2 O → 4Ag + O 2.
Scheele et Priestley pour cet élément chimique utilisé le composé (oxyde), de l'oxygène et de mercure (II).
3. La décomposition thermique des peroxydes de métaux ou de peroxyde d'hydrogène:
- 2BaO + O 2 → 2BaO 2.
- 2 2BaO → 2BaO + O 2.
- BaO 2 + H 2 SO 4 → H 2 O 2 + BaSO 4.
- 2H 2 O 2 → 2H 2 O + O 2.
Les premiers procédés industriels pour la séparation de l'oxygène de l'atmosphère ou pour la production de peroxyde d'hydrogène dépend de la formation d'un oxyde de peroxyde de baryum.
4. Électrolyse de l' eau avec de petits mélanges de sels ou d' acides qui fournissent la conduction du courant électrique:
2H 2 O → 2H 2 + O 2
la production industrielle
Si nécessaire pour obtenir de grandes quantités d'oxygène sont utilisés distillation fractionnée de l'air liquide. Parmi les principaux composants de l'air, il a le plus haut point d'ébullition et, par conséquent, par rapport à l'azote et l'argon moins volatile. Le procédé utilise un gaz de refroidissement au cours de son expansion. Les principales étapes de fonctionnement comme suit:
- l'air est filtré pour éliminer les particules solides;
- l'humidité et le dioxyde de carbone sont éliminés par absorption dans une solution alcaline;
- l'air est comprimé et on élimine la chaleur de compression par des procédés classiques de refroidissement;
- puis il pénètre dans le serpentin situé à l'intérieur de la chambre;
- une partie du gaz comprimé (à une pression d'environ 200 atm) dans la chambre se dilate, le refroidissement de la bobine;
- Les retours de gaz expansé au compresseur et passe par plusieurs étapes de compression et de l'expansion ultérieure, moyennant quoi à -196 ° C, l'air devient liquide;
- distillation liquide chauffé premier gaz inertes légers, puis restes d'azote et de l'oxygène liquide. Multiple fractionnement produit un produit suffisamment pur (99,5%) pour la plupart des applications industrielles.
Utilisation dans l'industrie
La métallurgie est le plus grand consommateur d'oxygène pur pour la production d'acier haute teneur en carbone: se débarrasser du dioxyde de carbone et d'autres impuretés non métalliques si rapide et plus facile qu'avec l'air.
promesse d'oxygène des eaux usées pour un traitement plus efficace des effluents liquides que dans d'autres procédés chimiques. Il devient de plus en plus important dans les systèmes d'incinération des déchets fermés à l' aide de O 2 pur.
Le comburant de missile que l'on appelle un atome d'oxygène liquide. O 2 pur Il est utilisé sur les sous – marins et dans la cloche de plongée.
Dans l'industrie chimique, l'oxygène remplace l'air ordinaire pour la production de substances telles que l'acétylène, l'oxyde d'éthylène et le methanol. Les applications médicales comprennent l'utilisation de l'oxygène gazeux dans les inhalateurs chambres et incubateurs pour bébés. gaz anesthésique enrichi en oxygène apporte un soutien de la vie pendant l'anesthésie générale. Sans cet élément chimique ont pu exister un certain nombre d'industries qui utilisent des fours. C'est ce que l'oxygène.

Les propriétés chimiques et réaction
Les grandes valeurs de l'affinité électronique et de l'électronégativité de l'oxygène sont des composants typiques qui présentent des propriétés métalliques. Tous les composés ont l'état d'oxydation négatif d'oxygène. Lorsque deux orbitales électroniques remplis, formée O 2- ion. Les peroxydes (O 2 2-) suppose que chaque atome a une charge de -1. Cette propriété d'accepter des électrons par une transmission totale ou partielle et détermine un agent oxydant. Lorsque l'agent réagit avec la substance, donneur d'électrons, son état d'oxydation diminue. La variation (diminution) de l'état d'oxydation de l'oxygène de zéro à -2 appelé récupération.
Dans des conditions normales, l'élément forme un composé dihydroxylique et trivalents. En outre, il existe des molécules extrêmement instables chetyrehatomnye. Sous forme diatomique deux électrons non appariés sont situés sur les orbitales non liantes. Ceci est confirmé par le comportement paramagnétique de gaz.
réactivité intense est parfois hypothèse d'ozone a expliqué que l'un des trois atomes est dans l'état « atomique ». Faire réagir cet atome est dissocié de l'O 3, en laissant l' oxygène moléculaire.
molécule O 2 à des températures normales et la pression ambiante faiblement réactifs. L'oxygène atomique est beaucoup plus actif. L'énergie de dissociation (O 2 → de 2O) est significative et 117,2 kcal mol.

liens
C tel non – métaux comme l' hydrogène, le carbone, le soufre, l' oxygène, forme une large gamme de composés liés de façon covalente, comprenant des oxydes non métalliques tels que l' eau (H 2 O), le dioxyde de soufre (SO 2) et de dioxyde de carbone (CO 2); des composés organiques tels que des alcools, des aldéhydes et des acides carboxyliques; des acides communs tels que les carbonique (H2 CO3), l' acide sulfurique (H 2 SO 4) et nitrique (HNO 3); et les sels correspondants tels que le sulfate de sodium (Na 2 SO 4), du carbonate de sodium (Na 2 CO 3) et de nitrate de sodium (NaNO 3). L' oxygène est présent sous la forme de O 2- ions dans la structure cristalline des oxydes métalliques solides, tels que le composé (oxyde), d' oxygène et de calcium CaO. superoxyde en métal (KO 2) contient de l'ion O 2 -, tandis que les peroxydes métalliques (BaO 2) contiennent des ions O 2 2-. composés oxygénés ont généralement un degré d'oxydation -2.
propriétés principales
Enfin, nous listons les principales propriétés de l'oxygène:
- Configuration électronique: 1s 2s 2 2 4 2 p.
- Numéro atomique: 8.
- Masse atomique: 15,9994.
- Point d'ébullition: -183,0 ° C
- Point de fusion: -218,4 ° C
- Densité (si la pression d'oxygène est de 1 atm à 0 ° C): 1,429 g / l.
- état d'oxydation -1, -2, 2 (dans les composés avec du fluor).