liaison métallique: le mécanisme de formation. Communication chimique Métal:
Tous les éléments chimiques connus dans le tableau périodique sont divisés arbitrairement en deux groupes: les métaux et non-métaux. Afin de devenir des éléments et des composés non seulement, les produits chimiques peuvent réagir les uns avec les autres, ils devraient exister sous la forme de composés simples et complexes.
C'est la raison pour laquelle certains électrons tentent d'adopter, et l'autre – pour donner. Reconstituant les uns des autres de manière à former différents éléments et molécules chimiques. Mais ce qui leur permet de tenir ensemble? Pourquoi est-il une telle question de force, de détruire qui transcendent même les instruments les plus graves? Et d'autres, à l'inverse, sont détruits par le moindre impact. Tout ceci est dû à la formation de divers types de liaisons chimiques entre les atomes dans les molécules formant la structure de réseau cristallin spécifique.
Les types de liaisons chimiques dans les composés
Total peut distinguer quatre principaux types de liaisons chimiques.
- Covalentes apolaire. Formé entre deux éléments non métalliques identiques en raison de partage d'électrons, en formant des paires d'électrons communs. Dans l'éducation, il est assisté à des particules de valence non appariés. Exemples: les halogènes, l'oxygène, l'hydrogène, l'azote, le soufre, le phosphore.
- covalente polaire. Formé entre deux différents éléments non métalliques ou entre très faible sur les propriétés du métal et de non-métal faible électronégativité. des paires d'électrons sous-jacents et généraux et en les tirant vers lui l'atome, dont l'affinité électronique ci-dessus. Exemples: NH 3, SiC, P 2 O 5 et d' autres.
- liaison d'hydrogène. Le plus instable et faible, est formée entre l'atome fortement électronégatif d'une molécule et l'autre positive. Ceci se produit le plus souvent lorsque des substances dissoutes dans l'eau (alcool, de l'ammoniac et ainsi de suite). Grâce à une telle liaison peut exister des protéines macromoléculaires, des acides nucléiques, des glucides complexes, et ainsi de suite.
- liaison ionique. Formée en raison de forces d'attraction électrostatiques des ions métalliques raznozaryazhennyh et non-métaux. Plus la différence de cet indice, plus prononcé est la nature ionique de l'interaction. Des exemples de composés: sel binaire, composé complexe – alcalin.
- liaison métallique, que le mécanisme de formation et les propriétés qui seront discutés plus loin. Formé en métaux, leurs alliages de divers types.
Il y a une chose telle que l'unité de la liaison chimique. Il dit simplement qu'il est impossible de considérer chaque référence obligataire. Ils sont tous simplement le symbole de l'unité. Après tout, la base de toutes les interactions est un principe – elektronnostaticheskoe interaction. Par conséquent, ionique, métallique, la liaison covalente et de l'hydrogène ont une seule nature chimique et ne sont que les cas limites à l'autre.
Les métaux et leurs propriétés physiques
Les métaux se trouvent dans la grande majorité de tous les éléments chimiques. Cela est dû à leurs propriétés particulières. Une partie significative a été obtenue par une personne par des réactions nucléaires en laboratoire, ils sont radioactifs à courte demi-vie.
Cependant, la majorité – sont des éléments naturels qui forment l'ensemble des roches et minerais, font partie des composés les plus importants. Il est à cause de ces gens ont appris à jeter des alliages et produire beaucoup de produits excellents et importants. C'est tel que le cuivre, le fer, l'aluminium, l'argent, l'or, le chrome, le manganèse, le nickel, le zinc, le plomb et d'autres.
Pour tous les métaux peuvent identifier les propriétés physiques communes qui explique la formation de liaison métallique du diagramme. Quelles sont ces caractéristiques?
- Malléabilité et ductilité. On sait que de nombreux métaux peuvent être roulés vers le bas, même au point de feuille (or, aluminium). De l'autre reçoivent un fil, des feuilles métalliques flexibles, capables d'articles déformés par impact physique, mais se remettre de sa résiliation. Ce sont les qualités de métaux et est appelé malléabilité et ductilité. La raison de cette fonction – un type de liaison métallique. Les ions et les électrons dans la lame de cristal par rapport à l'autre sans rupture, ce qui permet de préserver l'intégrité de toute la structure.
- lustre métallique. Cela explique aussi la liaison métallique, le mécanisme de formation de ses caractéristiques et de fonctionnalités. Ainsi, toutes les particules sont capables d'absorber ou réfléchir les ondes lumineuses de longueur égale. Atomes la plupart des métaux et refléter la teinte courte longueur d'onde des rayons deviennent sensiblement uniforme couleur argentée, blanc, bleu pâle. Les exceptions sont le cuivre et l'or, leur couleur est rougeâtre jaune et rouge, respectivement. Ils sont capables de réfléchir le rayonnement plus la longueur d'onde.
- conductivité thermique et électrique. Ces propriétés expliquent également la structure de réseau cristallin et en ce que sa formation est réalisée liaisons de type métallique. En raison de la « gaz d'électrons » se déplaçant dans le cristal, le courant électrique et de la chaleur rapidement et uniformément répartis entre tous les atomes et les ions et conduits à travers le métal.
- L'état d'agrégat solide dans des conditions normales. Ici, la seule exception est le mercure. Tous les autres métaux – est nécessairement forts, des liens solides, ainsi que leurs alliages. Il est également le résultat du fait que, en présence de liaison métal-métal. Le mécanisme de formation de ce type de propriétés de liaison de particules complètement confirmée.
Ces caractéristiques physiques de base pour les métaux, ce qui explique et détermine exactement diagramme formation d'une liaison métallique. composés pertinents tel procédé est d'atomes métalliques des éléments, de leurs alliages. C'est pour eux un solide et un état liquide.

Type métallique de liaison chimique
Quelle est sa fonction? Le fait est que cette relation est formée non pas par des ions raznozaryazhennyh et l'attraction électrostatique et non pas en raison de la différence d'électronégativité et la disponibilité des paires d'électrons libres. C.-à-ionique, métallique, liaison covalente ont plusieurs autre nature et les caractéristiques distinctives de particules de liaison.
Tous les métaux sont caractéristiques intrinsèques telles que:
- une petite quantité d'électrons dans le niveau d'énergie extérieure (à l'exception de quelques exceptions, pour lesquelles il peut y avoir 6,7 et 8);
- grand rayon atomique;
- faible énergie d'ionisation.
Tout cela contribue à une séparation facile des électrons non appariés sur le noyau externe. Dans ce cas, les libres de l'orbitals atome reste beaucoup. Schéma de la liaison métallique juste affiche de multiples cellules superposées de différentes atomes orbitales entre eux, qui aboutissent à la intracristallin et former un espace commun. Il sert électrons de chaque atome qui commencent promener librement sur les différentes parties du réseau. Périodiquement, dont chacun est attaché à un ion dans l'unité de cristal et le convertit en un atome, puis détaché de nouveau, en formant ions.
Ainsi, la liaison métallique – est la liaison entre des atomes, des ions et des électrons libres dans le cristal de métal total. Le nuage d'électrons, se déplacer librement à l'intérieur de la structure, dénommé « gaz d'électrons ». Il leur a été expliqué, la plupart des propriétés physiques des métaux et leurs alliages.
Comment met en œuvre spécifiquement une liaison chimique métallique? Les exemples sont différents. Considérons un morceau de lithium. Même si vous prenez la taille d'un pois, il y a des milliers d'atomes. Donc, imaginons que chacun de ces milliers d'atomes donne un électron de valence dans un seul espace cristallin commun. En même temps, connaissant la structure électronique de l'élément, vous pouvez voir le nombre de orbitals vacants. Lors de leur lithium est 3 (le second niveau d'énergie p-orbital). Trois chaque atome de dizaines de milliers – c'est un espace commun dans le cristal, dans lequel le « gaz électronique » se déplace librement.

Substance toujours forte liaison métallique. Après tout, le gaz d'électrons ne permet pas le cristal de tomber, mais seulement déplace les couches et récupère ensuite. Il brille ont une certaine densité (généralement élevée), fusibilité, malléabilité et ductilité.
À quel autre endroit réalisé lien métallique? Des exemples de substances:
- métaux tels que des structures simples;
- tous les alliages métalliques les uns avec les autres;
- tous les métaux et leurs alliages à l'état liquide et solide.
Des exemples spécifiques sont simplement une quantité incroyable, parce que le métal dans le tableau périodique, plus de 80!
liaison métallique: le mécanisme de formation
Si l'on considère en termes généraux, les principaux points que nous avons décrit plus haut. Disponibilité des orbitales atomiques et les électrons facilement détachés du noyau en raison de la faible énergie d'ionisation – sont les principales conditions pour la formation de ce type de communication. Ainsi, il apparaît qu'il est mis en œuvre entre les particules suivantes:
- atomes dans le réseau cristallin;
- les électrons libres, qui sont à la valence du métal;
- des ions dans le réseau cristallin.
Le résultat – une liaison métallique. Le mécanisme de formation généralement exprimé par l'entrée suivante: Me 0 – e – ↔ Me n +. D'après le diagramme évidemment, toutes les particules métalliques sont présents dans le cristal.
Les cristaux eux-mêmes peuvent avoir des formes différentes. Cela dépend du matériau avec lequel nous traitons.
Types de cristaux de métal
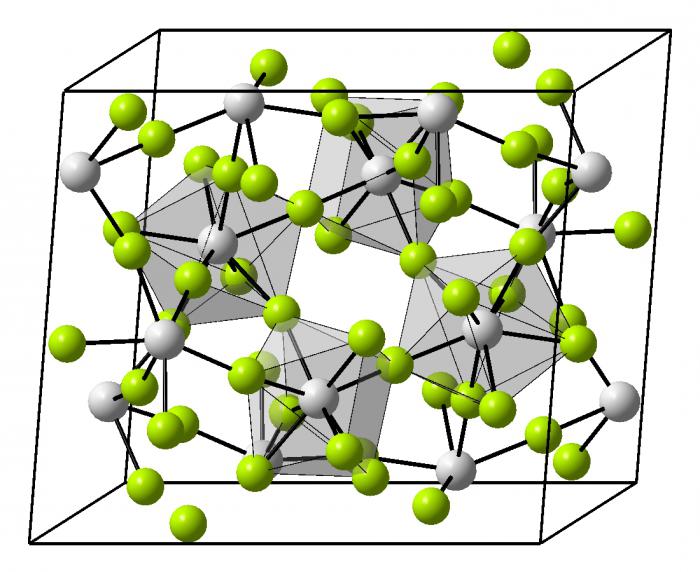
Cette structure du métal ou de l'alliage a une garniture très dense de particules. Il fournit des ions dans les sites de cristal. En eux-mêmes, le réseau peut être de différentes formes géométriques dans l'espace.
- Obemnotsentricheskaya réseau cubique – métaux alcalins.
- structure compacte Hexagonal – toutes les piles alcalines, à l'exception de baryum.
- Granetsentricheskaya cubique – aluminium, le cuivre, le zinc, de nombreux métaux de transition.
- la structure rhomboédrique – le mercure.
- Tétragonale – indium.
Les métaux lourds et les plus bas , il se trouve dans le système périodique, plus il est difficile emballage et l' organisation spatiale du cristal. Lorsque cette liaison chimique en acier, dont des exemples peuvent être réduits pour chaque métal existant est décisive dans la construction du cristal. Les alliages ont une organisation très diversifiée dans l'espace, certains d'entre eux ne sont toujours pas encore entièrement compris.

Spécifications de communication: nondirectionality
une liaison covalente et métal a une caractéristique très prononcée. Contrairement à la première, la liaison métallique est pas dirigée. Qu'est-ce que cela signifie? Autrement dit, le nuage d'électrons à l'intérieur du cristal se déplace tout à fait librement dans des directions différentes, chacun des électrons est en mesure de se joindre absolument tout ion dans la structure des nœuds. Autrement dit, l'interaction se fait dans des directions différentes. Par conséquent, on dit que la liaison métallique – non-directionnelle.
Le mécanisme de liaison covalente implique la formation de paires d'électrons partagées, à savoir les nuages d'atomes se chevauchent. Et il se produit strictement sur une certaine ligne reliant leurs centres. Par conséquent, parler de la direction d'une telle connexion.
saturabilité
Cette caractéristique reflète la capacité des atomes d'une interaction limitée ou illimitée avec d'autres. Par exemple, covalente et liaison métal sur cet indicateur sont à nouveau opposés.
La première est pleine. Les atomes impliqués dans sa formation sont un nombre fixe d'électrons de valence externes directement impliqués dans la formation du composé. Plus de manger, il ne sera pas les électrons. Par conséquent, le nombre de liaisons formées valence limitée. saturation donc due. En raison de cette caractéristique de la plupart des composés, il a une composition chimique constante.
des liaisons métalliques et d'hydrogène, d'autre part, la non-saturation. Cela est dû à de nombreux électrons et libres dans le orbitals cristal. Le rôle joué par les ions dans les sites du réseau cristallin, dont chacun peut être un atome et un ion de nouveau à tout moment.

Une autre caractéristique de la liaison métallique – nuage d'électrons interne de délocalisation. Il se manifeste par l'aptitude d'une petite quantité d'électrons partagés relier la pluralité de métaux des noyaux atomiques. Autrement dit, la densité de délocalisée car il est réparti à parts égales entre toutes les unités du cristal.
Des exemples de formation d'une liaison dans les métaux
Tenir compte de quelques modes de réalisation spécifiques, qui illustrent, à titre de liaison métallique est formée. Exemples Les substances suivantes:
- zinc;
- l'aluminium;
- potassium;
- chrome.
formation d' une liaison métallique entre les atomes de zinc: Zn 0 – 2e – ↔ Zn 2+. atome de zinc a quatre niveaux d'énergie. orbitales libre basé sur la structure électronique, il a 15 – 3 orbitales p, d 4 5 et 7 à 4f. Structure électronique comprennent: 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 3d 4d 10 4P 0 0 0 4f, seulement 30 électrons atomiques. À savoir, deux particules négatives de valence libre sont capables de se déplacer dans les 15 spacieuses et personne orbitals occupé. Et donc chaque atome. Le résultat – un énorme espace global composé de vide orbitals, et une petite quantité d'électrons reliant ensemble toute la structure.
La liaison métallique entre les atomes d'aluminium: Al 0 – e – ↔ Al 3+. Treize électrons des atomes d'aluminium situés à trois niveaux d'énergie, ils manquent clairement en abondance. Structure électronique: 1s 2s 2 2 6 3s 3p 2p 1 2 0 3d. Gratuit – 7 orbitals pièces. De toute évidence, le nuage d'électrons sera faible par rapport au total de l'espace interne dans le cristal.

Le chrome métallique de liaison. Cet élément particulier de leur structure électronique. Après tout, pour la stabilisation de la défaillance du système se produit avec 4s d'électrons à 3d orbital: 1s 2s 2 2p 2 6 2 3s 4s 3p 6 1 5 4p 3d 4d 0 0 0 4f. Seulement 24 valence électronique dont six sont. Ils vont à l'espace électronique commun sur la formation d'une liaison chimique. Gratuit 15 orbitals, qui est encore bien supérieure à celle nécessaire pour remplir. Par conséquent, le chrome – comme un exemple typique d'un métal avec une liaison correspondante de la molécule.
L'un des métaux les plus actifs qui réagissent même avec de l'eau ordinaire au feu, est le potassium. Ce qui représente ces propriétés? Encore une fois, à bien des égards – de type métallique d'obligations. Électrons dans l'élément seulement 19, mais ils sont situés jusqu'à 4 niveaux d'énergie. C'est 30 différents sous-niveaux orbitales. Structure électronique: 1s 2s 2 2p 2 6 2 3s 4s 3p 6 1 0 4P 3d 4d 0 0 0 4f. Seuls deux électrons de valence à très faible énergie d'ionisation. Libre de se détacher et aller à l'espace électronique commun. Orbitals de déplacer un atome pièces 22, à savoir un espace très étendu pour le « gaz d'électrons ».
Similitudes et différences avec d'autres types d'obligations
En général, cette question a déjà été abordée ci-dessus. On ne peut que généraliser et tirer une conclusion. Les principales caractéristiques distinctives de tous les autres types de caractéristiques de communication des cristaux métalliques sont les suivantes:
- Plusieurs types de particules impliquées dans le processus de liaison (atomes, ions ou atomes-ions, électrons);
- Différentes structures géométriques spatiales des cristaux.
Avec une liaison hydrogène et ionique, le métal combine l'insaturation et la non-directionnalité. Avec une attraction électrostatique polaire forte et covalente entre les particules. Séparément avec ionique – le type de particules dans les noeuds du réseau cristallin (ions). Avec des atomes non polaires covalents dans les noeuds du cristal.
Types d'obligations dans des métaux de différents états agrégés
Comme nous l'avons déjà noté ci-dessus, la liaison chimique des métaux, dont les exemples sont donnés dans l'article, est formée dans deux états globaux des métaux et leurs alliages: solides et liquides.
La question se pose: quel type de liaison est dans la vapeur de métal? Réponse: covalent polaire et non polaire. Comme dans tous les composés sous forme de gaz. C'est-à-dire, lorsque le métal est chauffé pendant une longue période et transféré d'un état solide à une liaison liquide, la structure cristalline est conservée. Cependant, lorsqu'il s'agit de transférer un liquide à un état de vapeur, le cristal est détruit et la liaison métallique est convertie en une covalente.