Les propriétés chimiques des métaux alcalino-terreux. L'utilisation de métaux alcalino-terreux. Les propriétés physiques du métal alcalino-terreux
Tenir compte des propriétés chimiques des métaux alcalino-terreux. Définir les caractéristiques de leur structure, la réception étant dans la nature, l'application.
La situation dans la SS
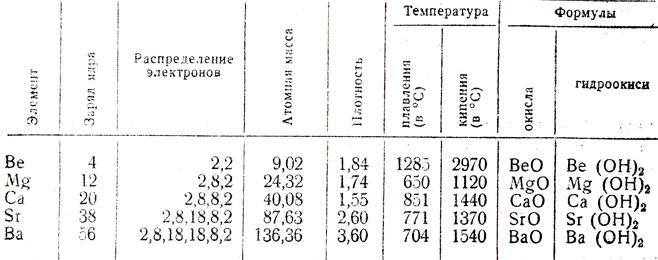
Pour définir l'emplacement de début de ces éléments dans le tableau périodique des Mendeleïev. Ils sont situés dans le second groupe des sous-groupes principaux. Ceux-ci comprennent le calcium, le strontium, le radium, le baryum, le magnésium, le béryllium. Ils sont tous sur le niveau d'énergie externe contient deux électrons de valence. En termes généraux, le béryllium, les métaux de magnésium et d'alcalino-terreux sont à l'extérieur des électrons NS2. Les composés chimiques qu'ils présentent l'état d'oxydation +2. Au cours de l'interaction avec d'autres substances, elles présentent des propriétés réductrices, donnant des électrons d'un niveau d'énergie externe.

Modification des propriétés
Avec l' augmentation de l' atome de béryllium de base, de magnésium et de métaux alcalino-terreux d' améliorer leurs propriétés métalliques, car il y a une augmentation du rayon de leurs atomes. Tenir compte des propriétés physiques des métaux alcalino-terreux. Le béryllium est à l'état normal est un métal gris avec un éclat métallique. Il a un réseau cristallin hexagonal dense. En contact avec l'oxygène, le béryllium former immédiatement un film d'oxyde, ce qui réduit sa réactivité, formé revêtement mat.
propriétés physiques
Le magnésium en tant que substance simple est un métal blanc formant le revêtement d'oxyde à l'air. Il a un réseau cristallin hexagonal.
Propriétés physiques des métaux alcalino-terreux calcium, le baryum, le strontium similaire. Ils représentent les métaux typiques avec des reflets argentés, couvrir sous l'influence d'un film jaune d'oxygène de l'air. Au calcium et strontium face-réseau cubique centré, le baryum a une structure centrée.
alcaline Chimie métal de terre basée sur le fait qu'ils ont une nature métallique de la relation. C'est pourquoi ils sont caractérisés par une forte conductivité électrique et de la chaleur. Les températures des points de fusion et d'ébullition supérieure à celle des métaux alcalins.

Méthodes de préparation
la production de béryllium à l'échelle industrielle est effectuée par réduction du fluorure de métal. L'état de l'écoulement de la réaction chimique est le préchauffage.
Étant donné que dans la nature des métaux alcalino-terreux sont sous la forme de composés de magnésium, de strontium, l'électrolyse de conduite de calcium de masses fondues de leurs sels.

propriétés chimiques
Les propriétés chimiques des métaux alcalino-terreux sont associés à la nécessité d'éliminer avant leur surface une couche de film d'oxyde. Il détermine l'inertie de ces métaux dans l'eau. Le calcium, le baryum, le strontium, lorsqu'il est dissous dans de l'eau pour former des hydroxydes ayant des propriétés basiques prononcé.
Les propriétés chimiques des métaux alcalino-terreux prennent leur interaction avec l'oxygène. Pour le produit de la réaction du peroxyde de baryum est, pour tous les autres oxydes formés après réaction. Tous les membres de cette classe d'oxydes présentent des propriétés de base, seules propriétés caractéristiques amphotères d'oxyde de béryllium.
Les propriétés chimiques des métaux alcalino-terreux sont représentés et en réaction avec du soufre, un atome d'halogène, de l'azote. Lorsque la réaction avec une dissolution acide de ces éléments est observée. Étant donné que le béryllium se rapporte à des éléments amphotères, il est capable de réagir chimiquement avec alcalis.

réactions qualitatives
Formules de base de métaux alcalino-terreux, vus au cours de la chimie inorganique associée à des sels. Pour identifier les membres de cette classe en combinaison avec d'autres éléments, vous pouvez utiliser la détermination qualitative. Lors de l'application du sel de métal alcalino-terreux dans la flamme lampe à alcool, la coloration de flamme cations observée. cation strontium donne une teinte rouge foncé, le cation calcium – ton orange et vert cation de baryum.
Identifier cation de baryum utilisé dans les anions de sulfate d'analyse qualitative. A la suite de cette réaction, un sulfate de baryum blanche qui est insoluble dans les acides minéraux.
Radium est un élément radioactif qui contient dans la nature en petites quantités. Lors de la réaction du magnésium avec de l'oxygène, il y a un flash brillant. Ce processus est utilisé pendant un certain temps en prenant des photos dans des endroits sombres. Maintenant remplacer le flash de magnésium est venu le système électrique. La famille des métaux alcalino-terreux désigne le béryllium, qui réagit avec de nombreux produits chimiques. Le calcium et le magnésium aluminium similaire, peuvent récupérer des métaux rares tels que le titane, le tungstène, le molybdène et le niobium. Ces procédés pour obtenir des métaux mentionnés kaltsietermiey et magnietermiey.

Caractéristiques de l'application
Quelle est l'utilisation de métaux alcalino-terreux? Le calcium et le magnésium sont utilisés pour la fabrication d'alliages légers et des métaux rares.
Par exemple, le magnésium est contenu dans la composition de duralumin, et le calcium – un alliages de plomb de composants utilisés pour préparer les gaines de câble et la création de paliers. Largement utiliser de métal alcalino-terreux dans la technique sous la forme d'oxydes. La chaux éteinte (oxyde de calcium) et brûlé magnésium (oxyde de magnésium) sont nécessaires pour le secteur de la construction.
Dans la réaction de l'oxyde de calcium avec de l'eau est libérée des quantités importantes de chaleur. de la chaux éteinte (hydroxyde de calcium) est utilisé pour la construction. La suspension blanche de la substance (lait de chaux) est utilisé dans l'industrie du sucre pour le processus de purification du jus de betterave.
Les sels de métaux du deuxième groupe
des sels de magnésium, de béryllium, de métaux alcalino-terreux peuvent être préparés par réaction avec des acides des oxydes respectifs. Les chlorures, les fluorures, les iodures des éléments de données sont des composés cristallins blancs, généralement bien soluble dans l'eau. Parmi les sulfates avoir une solubilité que le magnésium et le composé de béryllium. On observe une diminution de sels de béryllium au sulfate de baryum. Carbonates sont pratiquement insolubles dans l'eau ou une solubilité minimale.
Sulfures des éléments alcalino-terreux sont contenus en petites quantités dans les métaux lourds. Si vous les envoyez à la lumière, vous pouvez obtenir une variété de couleurs. Sulfures sont inclus dans les compositions luminescentes, appelée phosphores. Appliquer ces couleurs pour créer des cadrans lumineux, des panneaux de signalisation.
composés communs de métaux alcalino-terreux
Le carbonate de calcium est l'élément le plus abondant dans la surface de la terre. Elle fait partie des composés tels que le calcaire, le marbre, la craie. Parmi eux, l'utilisation principale est calcaire. Ce minéral est indispensable dans la construction, est considéré comme une excellente pierre de construction. En outre, les présents composés sont de la chaux vive et la chaux éteinte inorganique, verre et ciment.
L'utilisation de gravier calcaire contribue à la route, mais parce que la poudre peut réduire l'acidité du sol. craie naturelle est un plus vieux animaux shell. Ce composé est utilisé pour la fabrication du caoutchouc, du papier, des crayons création de l'école.
la demande en marbre d'architectes, sculpteurs. Il est fait de marbre ont été créés de nombreuses œuvres uniques de Michel-Ange. Une partie des stations du métro de Moscou est bordée de carreaux de marbre. le carbonate de magnésium est utilisé en grandes quantités dans la fabrication de briques, le ciment, le verre. Il est nécessaire dans l'industrie métallurgique pour l'élimination des stériles.
du sulfate de calcium contenu naturellement sous la forme de gypse (cristallin de sulfate de calcium) est utilisé dans l'industrie de la construction. En médecine, le composé est utilisé pour la production de moules, et pour produire des bandes de plâtre.
Stucco (hémihydrate de gypse) par réaction avec l'eau, dégage d'énormes quantités de chaleur. Il est également utilisé dans l'industrie.
le sel d'Epsom (sulfate de magnésium), utilisé en médecine comme laxatif. Cette substance a un goût amer, il se trouve dans l'eau de mer.
« Bouillie de barytine » (sulfate de baryum) est non soluble dans l'eau. Voilà pourquoi ce sel est utilisé en radiologie. Le sel contient les rayons X qui peuvent détecter les maladies du tractus gastro-intestinal.
La composition de la roche phosphatée (roche) et de phosphate de calcium est de l'apatite. Ils ont besoin pour produire des composés de calcium: oxydes, hydroxydes.
Le calcium joue pour les organismes vivants d'une importance particulière. Il est ce métal est essentiel pour la construction de squelette osseux. Les ions calcium sont nécessaires pour l'ajustement du cœur, augmenter la coagulation du sang. L'absence de celui-ci provoque un dysfonctionnement du système nerveux, la perte de la coagulation, la perte de capacité à garder la main normalement une variété d'articles.
Afin d'éviter des problèmes de santé, chaque jour devrait consommer environ 1,5 g de calcium. Le principal problème réside dans le fait que le corps absorbe 0,06 grammes de calcium devrait manger 1 gramme de matière grasse. La quantité maximale de métal contenue dans la laitue, le persil, le fromage blanc, du fromage.

conclusion
Tous les représentants du deuxième groupe du tableau périodique du sous-groupe principal nécessaire à la vie et le travail de l'homme moderne. Par exemple, le magnésium est un stimulateur de processus métaboliques dans le corps. Il doit être présent dans le tissu nerveux, le sang, les os, le foie. Le magnésium est un participant actif et la photosynthèse dans les plantes, car il fait partie de la chlorophylle. Les os humains sont environ un cinquième du poids total. Ce qu'ils contiennent du calcium et du magnésium. Oxydes, sels alcalins de métaux ont trouvé diverses applications dans l'industrie de la construction, la pharmacie et de la médecine.















