Comment écrire isomères et homologues? Comment être les isomères des alcanes?
Avant d' examiner comment produire des isomères d'hydrocarbures saturés à révéler des caractéristiques de cette classe de substances organiques.
hydrocarbures saturés
de nombreuses classes CxHy se trouve dans la chimie organique. Tout le monde a une formule générale, série homologue, réactions qualitatives, l' application. Pour la classe d'hydrocarbure alcane saturé liaison simple typique (sigma). La formule générale de cette classe de substances organiques CnH2n + 2. Ceci explique les propriétés chimiques de base: déplacement, combustion, oxydation. Pour paraffines ne sont pas typiques de rejoindre, puisque la communication dans les molécules de ces hydrocarbures simples.

isomérie
Le phénomène de isomérie explique la variété des substances organiques. Sous isomérie est phénomène communément compris dans lequel il y a plusieurs composés organiques ayant le même nombre d'éléments (nombre d'atomes de carbone dans la molécule), mais un agencement différent d'entre eux dans la molécule. Le matériau résultant est appelé isomères. Ils peuvent être des représentants de plusieurs classes d'hydrocarbures, et les propriétés chimiques différentes donc. alcanes molécules composées Divers atomes donne lieu à une isomérie structurale. Comment être les isomères des alcanes? Il existe un algorithme spécifique, selon ce qui peut être représenté par des isomères de structure de cette classe de substances organiques. Il y a une telle possibilité avec seulement quatre atomes de carbone, à savoir, une molécule de butane C4H10.
les espèces isomères
Pour comprendre comment écrire des formules isomères, il est important d'avoir une bonne compréhension de ses formes. En présence des mêmes atomes dans la molécule, en nombre égal, qui sont situés dans l'espace dans un ordre différent, se réfère à l'isomérie spatiale. Dans le cas contraire, il est appelé stéréoisomérie. Dans ce cas, l'utilisation d' une seule formule structurelle ne suffit pas, besoin d'utiliser la projection spéciale ou formules spatiales. des hydrocarbures saturés à partir de H3C-CH3 (éthane), ont diverses configurations spatiales. Ceci est dû à la rotation à l'intérieur de la molécule par une liaison C-C. Il est une σ-simple liaison crée un isomères conformationnels (rotatifs) sont possibles.

paraffines isomères structuraux
Parlons de la façon de faire des isomères alcanes. La classe possède un isomère structurel, à savoir une forme différente chaîne d'atomes de carbone. Dans le cas contraire, la possibilité de changer la position dans la chaîne d'atomes de carbone du squelette carboné appelé isomérie.
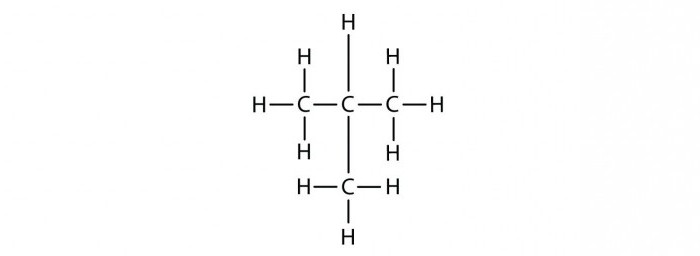
isomères d'heptane
Ainsi, en laissant les isomères de la substance ayant la composition C7H16? Pour commencer, vous pouvez organiser tous les atomes de carbone dans une chaîne longue, ajouter à chacun un certain nombre d'atomes C. Combien? Tenant compte du fait que la valence de carbone est égal à quatre, en atomes extrêmes à trois atomes d'hydrogène et à l'intérieur – deux. La molécule résultante possède une structure linéaire, un hydrocarbure appelée n – heptane. La lettre « n » désigne un squelette carboné linéaire dans l'hydrocarbure.
Maintenant, changer l'emplacement des atomes de carbone, « raccourcissement » dans ce cas, une chaîne de carbone directement dans C7H16. Créer isomères peuvent être sous la forme structurale expansé ou raccourcie. Considérons maintenant le deuxième mode de réalisation. atome première C organiser un radical méthyle en des positions différentes.
Actif heptane isomère, a le nom chimique suivant: 2-methylhexane. Maintenant « nous passons le » atome de carbone radical à l'autre. L'hydrocarbure saturé résultant appelé 3-méthylhexane.
Si nous continuons à aller de numérotation radicale va commencer sur le côté droit (plus près du sommet est un radical hydrocarboné), qui est, nous obtenons cet isomère, que nous avons déjà. Par conséquent, la réflexion sur la façon de faire la formule des isomères du produit de départ, va essayer de faire le squelette même « plus court ».
Les deux autres du carbone peut être présent sous la forme de deux radicaux libres – méthyle.
Tout d'abord les organiser dans les différents carbones inclus dans la chaîne principale. Nous appelons l'isomère résultant -2,3 diméthylpentane.
Maintenant laisser un radical au même endroit, et se déplace à la prochaine deuxième atome de carbone de la chaîne principale. Ce matériau est appelé 2,4 diméthylpentane.
Maintenant organiser les radicaux hydrocarbonés ont un atome de carbone. Dans un premier temps, le second, d'obtenir 2,2 diméthylpentane. Ensuite, la troisième réception diméthylpentane 3.3.
Maintenant, nous partons dans la chaîne principale de quatre atomes de carbone, les trois autres l'utilisation comme des radicaux méthyle. Nous les organisons comme suit: deux au second atome de carbone, un – le troisième carbone. Nous appelons isomère obtenu: 2,2, 3 triméthylbutane.
Dans l'exemple heptane, nous avons discuté comment faire des isomères d'hydrocarbures saturés. Dans les exemples image d'isomères structuraux sont représentés pour butena6 ses dérivés chlorés.
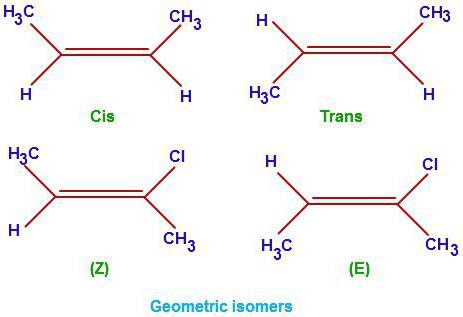
alcènes
Cette classe de substances organiques a la formule générale CnH2n. En plus des liaisons C-C saturés dans cette classe, il y a aussi une double liaison. Il détermine les propriétés de base de cette série. Parlons comment laisser les isomères d'alcènes. Laissez révéler leurs différences par rapport hydrocarbures saturés. En plus de l'isomérie de la chaîne principale (formule structurelle) pour les représentants de cette classe d'hydrocarbures organiques se caractérise également par trois espèces d'isomères géométriques (formes cis et trans), la position de liaison multiple et isomère interclasse (de cycloalcanes).
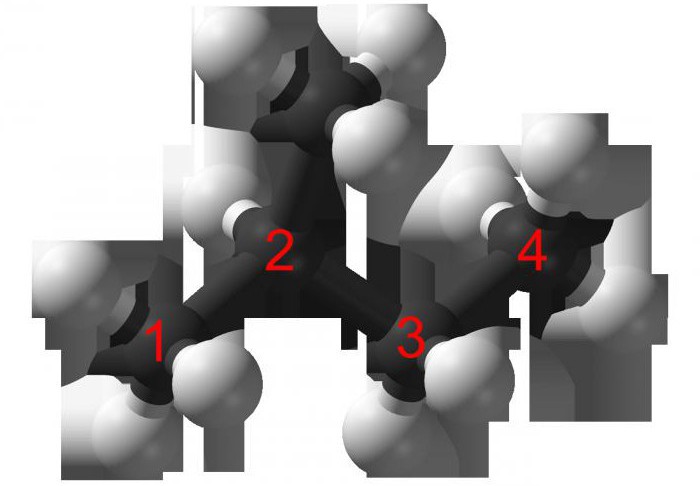
isomères de C6H12
Essayez de savoir comment composer les isomères C6H12, compte tenu du fait que la substance de la formule peut appartenir directement aux deux classes de composés organiques: les alcènes, les cycloalcanes.
Pour commencer, réfléchir à la façon d'être des isomères d'alcènes, s'il y a une double liaison dans la molécule. Mettre chaîne carbonée droite, mettre une liaison multiple après le premier atome de carbone. Nous essayons non seulement de faire des isomères de s6n12, mais aussi de nommer la substance. Ce matériau – hexène – 1 Les nombres indiquent la position dans la molécule une double liaison. Dans son mouvement le long de la chaîne de carbone, l'hexène et l'hexène obtenir -2 – 3
Maintenant, nous pensons comment faire des isomères de cette formule, en changeant le nombre d'atomes dans la chaîne principale.
Pour raccourcir le squelette carbone de départ un atome de carbone, il est considéré comme un radical méthyle. double liaison après le premier congé de l'atome S. L'isomère résultant de la nomenclature systématique aura le nom suivant: 2 méthylpentène – 1. Maintenant déplacer le groupe hydrocarbyle sur la chaîne principale, en laissant inchangée la position de la double liaison. Cet hydrocarbure insaturé est une structure ramifiée appelé 3 méthylpentène-1.
Il est possible sans changer la position de la chaîne principale et un isomère à double liaison: 4 méthylpentène-1.
Pour la composition C6H12 peut essayer de déplacer la double liaison de la première à la seconde position sans se transformer la chaîne principale. Le radical ainsi être déplacé le long du squelette carboné, depuis la seconde atomique S. Cet isomère a le nom 2 méthylpentène-2. En outre, il est possible de placer un radical troisième atome de carbone en obtenant ainsi CH3 3-méthylpentène 2
Lorsqu'il est placé dans le résidu à la quatrième chaîne d'atomes de carbone est formée une autre substance nouvelle hydrocarbure insaturé avec l'enroulement squelette carboné – 4 méthylpentène-2.
Avec une réduction supplémentaire du nombre C dans la chaîne principale, peut recevoir l'un des isomères.
La double liaison partira après le premier atome de carbone, et deux radicaux délivrer au troisième atome de carbone de la chaîne principale, dimetiluten obtenir 3,3-1.
Maintenant, nous avons mis radicaux sur des atomes de carbone adjacents, sans changer la position de la double liaison 2,3-diméthylbutyle obtenir une. Essayez sans modifier la taille de la chaîne principale, le déplacement de la double liaison à la seconde position. Les radicaux on peut ainsi fournir seulement 2 ou 3 atomes de C, ayant 2,3 diméthylbut-2.
D'autres isomères de structure pour un non alcènes donné, toute tentative de trouver la théorie conduira à la rupture de la structure des substances organiques A. M. Butlerova.

isomères spatiales C6H12
Maintenant, savoir comment produire des isomères et leurs homologues du point de vue isomérie spatiale. Il est important de comprendre que les cis et trans alcènes ne sont possibles que pour la position de la double liaison de 2 et 3.
Alors que dans une des radicaux hydrocarbonés plan formé cis – mesurée -2-hexène, et les radicaux arrangement dans des plans différents, la forme trans-hexène – 2.
interclasse isomères C6H12
Raisonnant sur la façon de faire des isomères et ne peuvent pas oublier leurs homologues à propos de ce mode de réalisation interclasse isomérie. Pour les hydrocarbures insaturés nombre d'éthylène, ayant la formule générale CnH2n ces isomères sont des cycloalcanes. La caractéristique de cette classe d'hydrocarbures est la présence d'une structure cyclique (en boucle fermée) dans la liaison simple saturée entre les atomes de carbone. Vous pouvez créer une formule de cyclohexane, le méthylcyclopentane, diméthylcyclobutane, trimetiltsiklopropana.
conclusion
La chimie organique est multiforme, énigmatique. La quantité de substances organiques est supérieure à plusieurs centaines de fois le nombre de composés inorganiques. Ce fait est facilement explicable par l'existence d'un tel phénomène unique sous forme d'isomères. Si une série homologue sont disposés dans la même structure et les propriétés des substances, en changeant la position des atomes de carbone dans la chaîne, sont de nouveaux composés cités isomères. Seulement après la théorie de la structure chimique des composés organiques ont été classés tous les hydrocarbures à comprendre les spécificités de chaque classe. L'une des dispositions de cette théorie, directement liée au phénomène de isomérie. Le grand chimiste russe, a été en mesure de comprendre, d'expliquer, de prouver que l'emplacement des atomes de carbone dépendent des propriétés chimiques de la substance, son activité reaktsionanya, application pratique. Si l'on compare le nombre d'isomères formé alcanes insaturés marginaux et alcènes, ce qui conduit certainement alcènes. La raison est qu'il ya une double liaison dans la molécule. Qu'il permet à cette classe de matière organique pour former non seulement les alcènes de différents types et structures, mais aussi de parler des isomères de meklassovoy avec cycloalcanes.