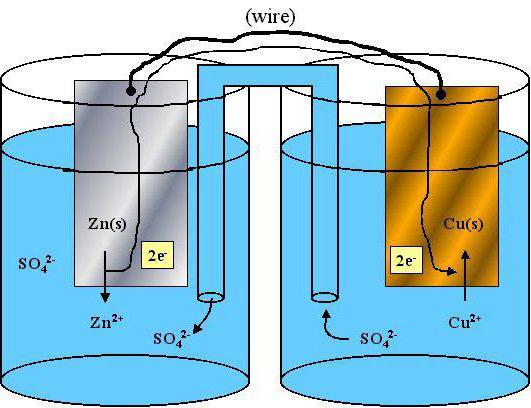
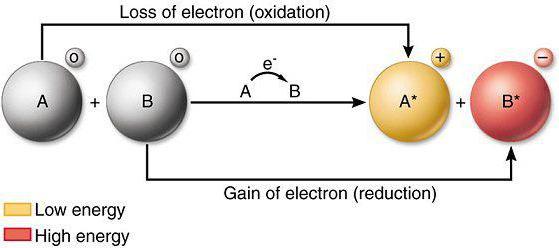
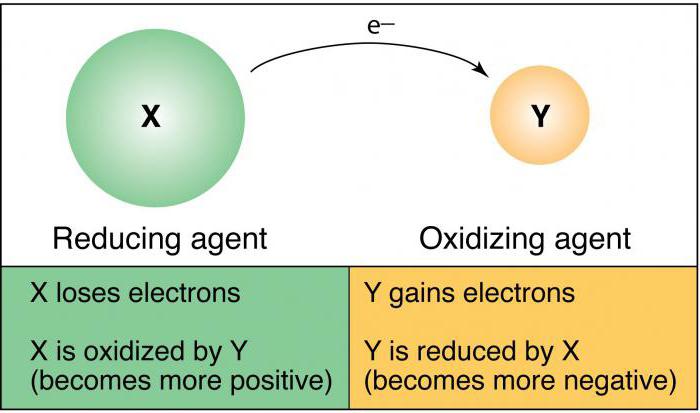
… propriétés réductrices ont des propriétés redox
propriétés oxydoréduction des atomes et des ions sont un problème important dans la chimie moderne. Ce matériau contribue à expliquer l'activité des éléments et des substances à procéder à une comparaison détaillée des propriétés chimiques des atomes différents.

Qu'est-ce que l'agent oxydant
De nombreux problèmes en chimie, y compris les questions de test de l'examen d'Etat unifié en 11 e année, et JEG dans la 9e année, associés à ce concept. L'oxydant est considéré comme atomes ou d'ions, qui, au cours de l'interaction chimique accepter des électrons provenant d'un autre ion ou atome. Si nous analysons les propriétés oxydantes des atomes doivent système périodique de Mendeleïev. Dans la période qui se trouvent dans le tableau de gauche à droite, la capacité d'oxydation de l'augmentation des atomes, à savoir, ont un propriétés non métalliques similaires. Les principaux sous-groupes similaires paramètre diminue vers le bas. Parmi les plus puissants de substances simples ayant une capacité d'oxydation, le fluorure de plomb. Un terme comme « électronégativité », il est possible de prendre un atome dans le cas d'interaction chimique des électrons peut être considéré comme synonyme de propriétés oxydantes. Parmi les substances complexes qui se composent de deux ou plusieurs éléments chimiques peuvent être considérés comme des oxydants lumineux: permanganate de potassium, le chlorate de potassium, l'ozone.

Quel est le réducteur
La réduction des propriétés typiques pour des atomes de substances simples présentant des propriétés métalliques. Dans les périodes de la classification périodique des propriétés métalliques, à gauche affaiblies, et dans les principaux sous-groupes (vertical), elles sont amplifiées. L'essence de la reprise de l'impact des électrons, qui sont situés sur le niveau d'énergie extérieure. Plus le nombre de coquilles d'électrons (niveaux), plus facile à envoyer lors de l'interaction chimique des électrons « extra ».
excellentes propriétés réductrices sont des métaux actifs (alcalino-terreux, alcalin). En outre, les substances présentant des paramètres similaires qui distinguent les oxydes de soufre (6), monoxyde de carbone. Afin d'obtenir le degré d'oxydation maximal, les composés doivent montrer des propriétés réductrices.
Le procédé d'oxydation
Si, au cours de l'interaction chimique de l'atome ou ion perd des électrons à un autre atome (ion), se réfère au processus d'oxydation. Pour une analyse de la façon dont les changements des propriétés réductrices et la capacité oxydative, éléments requis du tableau périodique, ainsi que la connaissance des lois actuelles de la physique.

Procédé de récupération
procédés de réduction comprennent l'adoption d'ions ou d'électrons par des atomes autres atomes (ions) au cours de l'interaction chimique directe. D'excellents agents réducteurs sont les nitrites, les sulfites de métaux alcalins. La réduction des propriétés des éléments dans le système de changement de propriétés métalliques semblables à des substances simples.
algorithme d'analyse OVR
Pour réaction chimique prêt de l'étudiant pour organiser les coefficients, vous devez utiliser un algorithme spécial. propriétés d'oxydoréduction aider à résoudre une variété de tâches de conception en chimie analytique, organique, général. Pour offrir une analyse de la réaction:
- Tout d'abord, il est important de définir chaque élément d'oxydation disponible, en utilisant les règles.
- Définissez ensuite les atomes ou d'ions, qui ont changé leur état d'oxydation pour être impliqués dans la réaction.
- Marques « moins » et « plus » indiquent le nombre de fonte adopté lors de la réaction chimique des électrons libres.
- En outre, entre le nombre d'électrons est déterminée par le multiple commun minimum, à savoir un nombre entier qui est divisible par des électrons sont acceptés et rendus.
- Ensuite, il est divisé en électrons qui participent à des réactions chimiques.
- Ensuite, on détermine exactement quels ions ou des atomes ont des propriétés réductrices, ainsi que de déterminer les oxydants.
- Au stade final des coefficients de pose dans l'équation.
L'application de la méthode de la balance électronique, de placer les coefficients dans un schéma réactionnel donné:
NaMnO 4 + acide sulfurique + hydrogène sulfuré = S + SO 4 Mn + … + …
Algorithme pour résoudre ce problème
On retrouve exactement ce qui doit être formé après l'interaction de la matière. Etant donné que la réaction est déjà oxydant (ils manganèse) et défini agent réducteur (ce sera le soufre), qui est formée substance ne change pas le degré d'oxydation. Etant donné que la réaction principale a lieu entre le sel et l'acide fort contenant de l'oxygène, puis une de la substance d'extrémité aura de l'eau, et le second – sel de sodium, plus précisément, le sulfate de sodium.
Revenons maintenant plan et l'adoption de l'électron:
– Mn 7 5 a e = Mn +2.
La deuxième partie du programme:
– S -2 S = 0 otdaet2e
Nous avons mis dans les vitesses de réaction initiales, sans oublier de résumer tous les atomes de soufre dans les côtés de l'équation.
2NaMnO 4 + 5H 2 S + 3 H 2 SO 4 = 5S + 2MnSO 4 + 8H 2 O + Na 2 SO 4.
L'analyse OVR impliquant le peroxyde d'hydrogène
L'application de l'analyse de l'algorithme OVR peut assimiler la réaction chimique:
le peroxyde d' hydrogène + acide sulfurique + potassium permagnanat = Mn SO 4 + oxygène + … + …
L' oxydation a changé d' ions d'oxygène (peroxyde d'hydrogène) et de cations de manganèse pour le permanganate de potassium. Autrement dit, un agent réducteur et un agent oxydant, nous sommes présents.
Définir ce qui peut encore se produire un matériau après l'interaction. L'un d'eux est de l'eau, ce qui est évidemment représentée par la réaction entre l'acide et le sel. Potassium pas former une nouvelle substance, le second produit de sel de potassium, à savoir sulfate, comme la réaction se déroule avec de l'acide sulfurique.
conduite:
2O – 2 donne électrons et transformé en O 2 0 5
Mn 7 5 reçoit des électrons et devient un ion 2 Mn 2
Nous mettons les taux.
5H 2 O 2 + 3H 2 SO 4 + 2KMnO = 5O 2 4 + 2Mn SO 4 + 8H 2 O + K 2 SO 4
EXEMPLE OVR analyse avec du chromate de potassium
En utilisant la méthode de balance électronique, établir une équation avec des coefficients:
FeCl 2 + Acide chlorhydrique + potassium chromate = FeCl 3 + CrCl 3 + … + …
fer à l'état d'oxydation modifié (chlorure de fer II) et les ions chrome dans le bichromate de potassium.
Maintenant, nous essayons de comprendre ce que les autres substances sont formées. On peut être un sel. Comme potassium ne se forme aucun composé ainsi le deuxième produit est un sel de potassium, plus précisément, du chlorure, parce que la réaction a eu lieu avec de l'acide chlorhydrique.
Pour tracer:
Fe 2 envoie e = Fe 3 6 réducteur
2Cr 6 6 reçoit 2Cr e = 3 1 comburant.
Nous posons les coefficients dans la réaction initiale:
6K 2 Cr 2 O 7 + FeCl 2 + 14HCl = 7H 2 O + 6FeCl 3 + 3 + 2KCl 2CrCl
EXEMPLE analyse syntaxique OVR avec de l'iodure de potassium
Armé des règles, établir une équation:
permanganate de potassium de l'acide sulfurique + + iodure de potassium, le sulfate de manganèse + … iodo + … + …
état d'oxydation du manganèse a changé et l'iode. C'est le réducteur et oxydant sont présents.
Maintenant, nous découvrons à la fin nous avons formé. Le composé aura potassium, à savoir obtenir du sulfate de potassium.
processus de réduction se produisent dans les ions d'iode.
Former le système de transfert d'électrons:
– Mn 7 5 reçoit e = Mn 2 2 est un agent oxydant,
– 2I – donne E = I 2 2 0 5 est un agent réducteur.
Nous arrangeons les coefficients dans la réaction initiale, sans oublier de résumer tous les atomes de soufre dans l'équation.
210KI + KMnO 4 + 8H 2 SO 4 = 2MnSO 4 + 2 + 5I 6K 2 SO 4 + 8H 2 O
EXEMPLE parsing OVR avec du sulfite de sodium
En utilisant la méthode classique, nous dressons schémas pour l'équation:
– Acide sulfurique + KMnO 4 + … sulfite de sodium, le sulfate de sodium, le sulfate de manganèse + … + … +
Après la réaction d'obtenir de l'eau de sel de sodium.
Pour tracer:
– Mn 7 5 reçoit e = Mn 2 2
– S +4 2 envoie e = S +6 5.
Nous arrangeons les coefficients dans cette réaction est oublie pas de mettre les atomes de soufre dans l'établissement des coefficients.
3H 2 SO 4 + 4 + 2KMnO 5Na 2 SO 3 = K 2 SO 4 + 4 + 2MnSO 5Na 2 SO 4 + 3H 2 O.
EXEMPLE parsing OVR avec de l'azote
Effectuez les tâches suivantes. En utilisant l'algorithme, nous formons une équation de réaction complète:
– le nitrate de manganèse + acide nitrique + PbO 2 = HMnO 4 + Pb (NO 3) 2 +
Analysons quelle substance même des formes. Etant donné que la réaction a eu lieu entre un agent oxydant fort et le sel, puis la substance est de l'eau.
Nous montrerons le changement dans le nombre d'électrons:
– Mn 2 5 envoie e = Mn 7 2 présente les propriétés d'un agent réducteur,
– Pb +4 2 reçoit e = Pb 2 5 oxydant.
3. Nous arrangeons les coefficients dans la réaction initiale, ajouter soigneusement tout l'azote présent dans le côté gauche de l'équation initiale:
– 2Mn (NO 3) 2 + 3 + 6HNO 5PbO 2 = 2HMnO 4 + 5PB (NO 3) 2 + 2H 2 O.
Dans cette réaction, des propriétés réductrices ne se manifestent pas d'azote.
Un second échantillon de la réaction d'oxydo-réduction avec de l'azote:
Zn + acide sulfurique + HNO 3 = ZnSO 4 + NO + …
– Zn 0 2 envoie e = Zn 2 3 soit un agent réducteur,
N 5 3 reçoit e = N 2 2 est l'oxydant.
Nous plaçons les coefficients dans une réaction prédéterminée:
3Zn + 3H 2 SO 4 + 2HNO 3 = 3ZnSO 4 + 2NO + 4H 2 O.
L'importance des réactions redox
La réaction de réduction la plus connue – la photosynthèse, une plante typique. Comment modifier les propriétés de récupération? Le processus se produit dans la biosphère, elle conduit à une augmentation de l'énergie d'une source externe. Il est cette énergie et utilise pour leurs besoins de l'humanité. Des exemples de réactions d' oxydation et de réduction associées à des éléments chimiques, sont d' une importance particulière à convertir des composés d'azote, de carbone, d' oxygène. Grâce à la photosynthèse de l'atmosphère de la Terre a une telle composition qui est nécessaire pour le développement des organismes vivants. Grâce à la photosynthèse ne pas augmenter le dioxyde de carbone dans le boîtier de l'air, la surface de la Terre est pas surchauffé. La plante se développe non seulement par réaction redox, mais les formes souhaitées telles substances à des humains, tels que l'oxygène, le glucose. Sans cette réaction chimique ne peut pas être un cycle complet de la matière dans la nature, ainsi que l'existence de la vie organique.
Application pratique OVR
Afin de maintenir la surface du métal, il est nécessaire de savoir qui ont des propriétés réductrices des métaux actifs, il est donc possible de recouvrir la couche de surface au-dessus de l'élément actif, ce qui ralentit le processus de corrosion chimique. En raison des propriétés redox par le nettoyage et la désinfection de l'eau potable. Ni l'un problème ne peut être résolu sans avoir correctement placé dans les coefficients de l'équation. Afin d'éviter les erreurs, il est important d'avoir une idée de tous les paramètres redox.
Protection contre la corrosion chimique
défi particulier à la vie et l'activité humaine est la corrosion. En raison de la conversion chimique de défaillance du métal, perdre leurs pièces automobiles de performance, des machines-outils. Afin de remédier à un tel problème, en utilisant une protection sacrificielle, une couche de revêtement métallique de vernis ou de peinture à appliquer les alliages anticorrosifs. Par exemple, la surface d'acier est recouverte d'une couche de métal actif – aluminium.
conclusion
Une variété de réactions de réduction se produisent dans le corps, assurer le fonctionnement normal du système digestif. De tels processus de vie de base comme la fermentation, la putréfaction, la respiration, également associés à des propriétés réductrices. Ont des caractéristiques similaires, tous les êtres vivants sur notre planète. Sans réaction avec dévouement et l'acceptation d'électrons ne peut pas être l'exploitation minière, la production industrielle d'ammoniac, alcalis, acides. Dans toutes les techniques de chimie analytique analyse volumétrique est basée sur les processus d'oxydo-réduction. Combattez avec ce phénomène désagréable de la corrosion chimique, elle est également basée sur la connaissance de ces processus.