Dans les composés de 4 Réagit d'oxyde de carbone? Quelles substances ont réagi le dioxyde de carbone?
Le dioxyde de carbone, également connu sous le 4 oxyde de carbone réagit avec un certain nombre de substances formant une grande variété de composition chimique et les propriétés du composé. Composé de molécules non polaires, il a une très faible liaisons intermoléculaires et ne peut être sous forme de gaz, si la température est supérieure à 31 degrés Celsius. Le dioxyde de carbone est un composé chimique constitué d'un atome de carbone et deux atomes d'oxygène.

Le dioxyde de carbone 4: Formule et Informations générales
Le dioxyde de carbone présent dans l'atmosphère à des concentrations faibles, et agit comme un gaz à effet de serre. Sa formule chimique est CO 2. A des températures élevées, il ne peut exister que dans l'état gazeux. Dans son état solide, on l'appelle la glace sèche.
Le dioxyde de carbone est un élément important du cycle du carbone. Il provient d'une variété de sources naturelles, y compris dégazage volcanique, la combustion de la matière organique et les processus respiratoires aérobie des organismes vivants. Les sources anthropiques de dioxyde de carbone sont principalement associés à la combustion de divers combustibles fossiles pour la production d'énergie et de transport.

Il est également produit par divers micro-organismes de fermentation et la respiration cellulaire. Les plantes convertissent le dioxyde de carbone à l'oxygène au cours d'un processus appelé photosynthèse, utilisant à la fois le carbone et l'oxygène pour former des hydrates de carbone. De plus, les plantes libèrent également de l'oxygène dans l'atmosphère, qui est ensuite utilisé pour la respiration par des organismes hétérotrophes.
Le dioxyde de carbone (CO2) dans le corps
Le monoxyde de carbone est mis à réagir avec 4 substances différentes et un produit de déchet gazeux du métabolisme. Il existe plus de 90% du sang sous la forme de bicarbonate (HCO 3). Autres – est soit dissous CO 2 ou de l' acide carbonique (H2CO 3). Pour l'équilibre de ces composés dans le sang des organes responsables tels que le foie et les reins. Bicarbonate – est une substance chimique qui agit comme un tampon. Il maintient le pH sanguin à un niveau souhaité, en évitant l'augmentation de l'acidité.

La structure et les propriétés du dioxyde de carbone
Le dioxyde de carbone (CO 2) est un composé chimique qui est un gaz à température ambiante et au- dessus. Il se compose d'un atome de carbone et deux atomes d'oxygène. Les humains et les animaux émettent du dioxyde de carbone quand expirez. De plus, il est toujours formé lorsque quelque chose d'organique brûlé. Les plantes utilisent le dioxyde de carbone pour la production alimentaire. Ce processus est appelé la photosynthèse.
propriétés de dioxyde de carbone ont été étudiées par le scientifique écossais Joseph Black de retour dans les années 1750. Est un gaz à effet de serre, est en mesure de capter l' énergie thermique et avoir un impact sur les conditions climatiques et météorologiques sur notre planète. Il est la cause du réchauffement climatique et augmentation de la température de la surface de la Terre.
Le rôle biologique
Le monoxyde de carbone est mis à réagir avec 4 substances différentes et est le produit final dans les organismes qui reçoivent l'énergie de la destruction des sucres, des graisses et des acides aminés. Ce processus est connu sous le nom de la respiration cellulaire, caractéristique de toutes les plantes, les animaux, de nombreux champignons et certaines bactéries. Chez les animaux supérieurs, le dioxyde de carbone dans le sang se déplace à partir des tissus du corps vers les poumons où il est exhalé. Les plantes obtenues à partir de l'atmosphère pour la photosynthèse.
glace carbonique
La glace sèche ou du dioxyde de carbone solide est un gaz à l' état solide de CO 2 avec la température -78,5 ° C Dans sa forme naturelle, il est une substance non trouvée dans la nature, mais faite par l'homme. Il est incolore et peut être utilisé pour la préparation de boissons gazeuses, comme un élément de refroidissement dans des contenants de crème glacée et en cosmétologie, par exemple pour le gel des verrues. Une paire de glace sèche peut provoquer un étouffement et entraîner la mort. Lors de l'utilisation de la glace sèche doit faire preuve de prudence et de professionnalisme.
A la pression normale , il ne fondra pas de solide à l'état liquide, et procède directement à la place du solide au gaz. Ceci est appelé sublimation. Il changera directement du solide au gaz à une température supérieure à la température extrêmement basse. La glace sèche à des températures normales sublimer. Cela libère le dioxyde de carbone, ce qui n'a pas d'odeur et de couleur. Le dioxyde de carbone peut être liquéfié à une pression supérieure à 5,1 atm. Gaz qui est libéré du froid de la glace sèche de sorte que, lorsqu'il est mélangé avec de l'air il refroidit la vapeur d'eau dans l'air sous forme de brouillard, qui ressemble à une fumée blanche dense.
Préparation des propriétés chimiques et réaction
Dans l'industrie, l'oxyde de carbone 4 a été préparé de deux façons:
- En brûlant du combustible (C + O 2 = CO 2).
- Par décomposition thermique de calcaire (CaCO 3 = CaO + CO 2).
La quantité résultante de monoxyde de carbone est purifié 4 est liquéfié et injecté dans des ballons spéciaux.
Comme acide, l'oxyde de carbone 4 est mis à réagir avec des matières telles que:
- Eau. Lorsque formes dissoutes de l' acide carbonique (H 2 CO 3).
- Les solutions alcalines. 4 Le monoxyde de carbone (formule CO 2) est mis à réagir avec des alcalis. Dans ce sel d' acide milieu et formé (NaHCO 3).
- oxydes basiques. Dans ces réactions sels formés carbonates (CaCO 3 et Na 2 CO 3).
- Carbon. 4, lorsque du monoxyde de carbone est mis à réagir avec du charbon chaud, 2 est formé d'oxyde de carbone (monoxyde de carbone), ce qui peut provoquer un empoisonnement. (CO 2 + C = 2CO).
- Le magnésium. En règle générale, le dioxyde de carbone ne soutiendra pas la combustion, seulement à des températures très élevées, il peut réagir avec certains métaux. Par exemple, un litre de magnésium continuera à brûler au CO 2 lors de la réaction d'oxydo – réduction (2 mg + CO 2 = 2MgO + C).

réaction qualitative du monoxyde de carbone manifesté 4 en le faisant passer à travers un 2 ou l' eau à travers barytine eau calcaire (Ca (OH) (Ba (OH) 2. On peut observer la turbidité et la précipitation. Si continuer à couler le dioxyde de carbone, l' eau redevienne transparent , sous forme de carbonates insolubles sont transformés en carbonates acides solubles (sel acide de l'acide carbonique).

Le dioxyde de carbone est également produit lors de la combustion de tous les combustibles à base de carbone tel que le méthane (gaz naturel), les distillats de pétrole (essence, le carburant diesel, le kérosène, le propane), du charbon ou du bois. Dans la plupart des cas, l'eau est également mis en évidence.
dioxyde de carbone (gaz carbonique) est constitué d'un atome de carbone et deux atomes d'oxygène qui sont maintenues ensemble par des liaisons covalentes (ou division électrons). carbone pur est très rare. Il se trouve que dans la nature sous forme de minéraux, le graphite et le diamant. Malgré cela, il est un élément constitutif de la vie, qui, en combinaison avec des formes d'hydrogène et d'oxygène d'un composé basique, qui tous sont constitués de la planète.
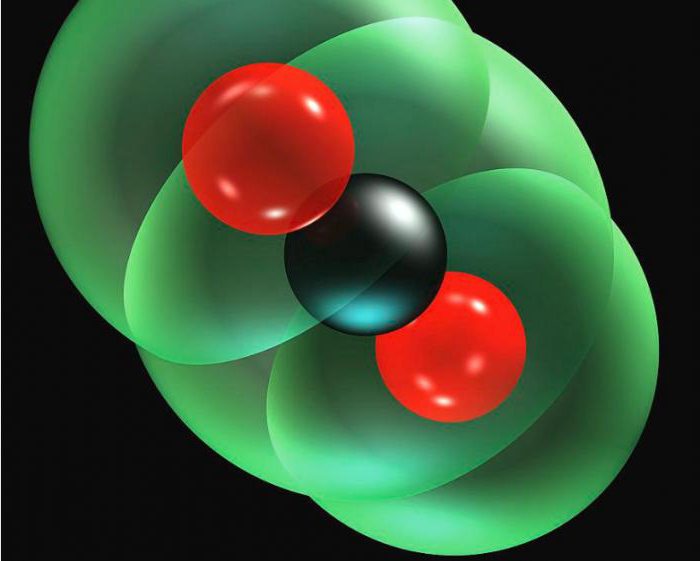
Des hydrocarbures tels que le charbon, le pétrole et le gaz naturel – un composé formé de carbone et d'hydrogène. Cet élément est contenu dans calcite (CaCO3) et de minéraux dans les roches sédimentaires et métamorphiques calcaire et le marbre. Cet élément, qui comprend toutes les matières organiques – à partir de combustibles fossiles à l'ADN.