Halogènes: propriétés physiques, propriétés chimiques. L'utilisation des composés halogénés et leurs
Les halogènes dans le tableau périodique à la gauche des gaz nobles. Ces cinq éléments métalliques toxiques inclus dans le groupe 7 du tableau périodique. Ceux-ci comprennent le fluor, le chlore, le brome, l'iode et l'astate. Bien que astate radioactifs et ne dispose que des isotopes de courte durée, il se comporte comme l'iode et est souvent considéré comme halogènes. Comme les éléments d'halogène sont sept électrons de valence, il ne nécessite qu'un seul électron supplémentaire pour former un octet complet. Cette caractéristique les rend plus actifs que les autres groupes de non-métaux.
caractéristiques générales
Les halogènes forment une molécule diatomique (X 2 de type où X est un halogène) – halogènes existence forme stable de cellules libres. Le contact de molécules diatomiques sont apolaire, et covalente simple. Les propriétés chimiques des halogènes leur permettent de former facilement des composés avec la plupart des éléments, de sorte qu'ils ne sont jamais trouvés sous la forme non liée dans la nature. Fluoro – halogène le plus actif et astatine – moins.
Tout groupe I forment des sels halogènes avec des propriétés similaires. Dans ces composés, les halogénures sont présents sous forme d' un anion halogénure avec une charge de -1 (par exemple, Cl -, Br -). Mettre fin à -id indique la présence d'anions halogénure; par exemple Cl – appelé « chlorure ».
En outre, les propriétés chimiques des halogènes leur permettent d'agir comme agents oxydants – métaux oxydés. La plupart des réactions chimiques impliquant des halogènes – redox en solution aqueuse. Les halogènes forment des liaisons simples avec du carbone ou de l' azote dans des composés organiques, où est égal à -1 du degré d'oxydation (CO). Lorsqu'il est substitué par un atome d'halogène un atome d'hydrogène lié de manière covalente à un composé organique, le préfixe halo peut être utilisé dans un sens général, ou préfixes fluoro-, chloro-, bromo-, iodo- – halogènes spécifiques. éléments halogènes peuvent avoir une liaison croisée pour former des molécules diatomiques avec des liaisons simples covalentes polaires.
Chlore (Cl 2) a été le premier halogène ouvert en 1774, puis à ouvrir l' iode (I 2), le brome (Br 2), le fluor (F 2) et l' astate (At, trouvé dernière à 1940 YG). Le nom « halogène » est dérivé de la racine grecque hal- ( «sel») et -gen ( «forme»). Ensemble, ces mots signifient « formant un sel », en insistant sur le fait que l'halogène réagit avec des métaux pour former des sels. Halite – le nom de sel gemme, minéral constitué de chlorure de sodium (NaCl). Enfin, l'halogène utilisé dans la maison – contient du fluor dans le dentifrice, chloro désinfecter l'eau potable, l'iode et favorise le développement des hormones thyroïdiennes.
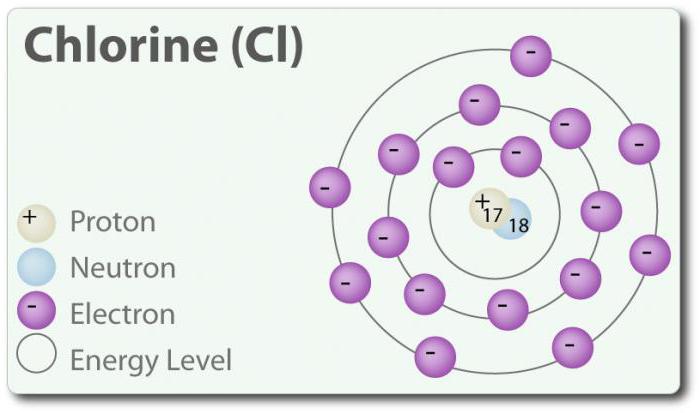
éléments chimiques
Fluoro – élément dont le numéro atomique 9, est désignée par F. Le fluor élémentaire a été découvert en 1886 g en l'isolant de l'acide fluorhydrique.. A l'état libre , il existe sous la forme de molécules diatomiques fluorées (F 2) et est l'halogène le plus commun, dans la croûte. Fluoro – élément le plus électronégatif du tableau périodique. A température ambiante, un gaz jaune pâle. Le fluor a aussi un rayon atomique relativement petit. Son CO – -1 sauf état diatomique élémentaire dans lequel l'état d'oxydation est de zéro. Fluoro extrêmement chimiquement actif et interagit directement avec tous les éléments à l'exception de l'hélium (He), le néon (Ne) et l'argon (Ar). La solution de H 2 O, l' acide fluorhydrique (HF) est un acide faible. Bien que fluoro très électronégatif, son électronégativité pas déterminer l'acidité; HF est un acide faible en raison du fait que l'ion fluorure est basique (pH> 7). En outre, le fluor produit des oxydants très puissants. Par exemple, le fluor peut réagir avec le xénon de gaz inerte et forme une forte difluorure de xénon oxydant (XeF 2). Dans de nombreuses applications de fluorure.

Le chlore – élément dont le numéro atomique 17 et le symbole chimique Cl. Découvert en 1774 par g. Distinguer de l'acide chlorhydrique. Dans son état élémentaire , il forme une molécule diatomique Cl 2. Le chlore a plusieurs SB-1, 1, 3, 5 et 7. A la température ambiante, il est un gaz vert clair. Étant donné que la liaison qui est formée entre les deux atomes de chlore, est faible, molécule Cl 2 a une capacité très élevée d'entrer dans la connexion. Le chlore réagit avec des métaux pour former des sels, qui sont appelés chlorures. Les ions chlorure sont des ions les plus abondants contenus dans l'eau de mer. Le chlore a également deux isotopes: 35 Cl et 37 Cl. Le chlorure de sodium est la connexion la plus commune de tous les chlorures.
Brome – un élément chimique avec le numéro atomique 35 et de symbole Br. Il a été découvert en 1826 sous la forme de brome élémentaire est molécule diatomique, Br 2. A température ambiante, il est un liquide brun rougeâtre. Son CO – -1, + 1, 3, 4 et 5. Bromo plus actif que l'iode, mais est moins actif que le chlore. En outre, isotope du brome a deux 79 Br et 81 Br. Le brome se produit dans la forme de sels de bromure, dissous dans l' eau de mer. Ces dernières années, la production de bromure dans le monde a augmenté de manière significative en raison de sa disponibilité et de longue vie. Comme avec d'autres halogènes brome et l'oxydant, il est très toxique.

Iode – élément chimique dont le numéro atomique 53 et le symbole I. L'oxydation de l'iode a: -1, 1, 5 et 7. Il est sous la forme d'une molécule diatomique, I 2. A température ambiante, la substance solide est violet. L' iode a un isotope stable – 127 I. D' abord découvert en 1811, avec l'aide d'algues et d' acide sulfurique. À l'heure actuelle, les ions d'iode peuvent être isolés dans l'eau de mer. Malgré le fait que l'iode n'est pas très soluble dans l'eau, peut être augmentée sa solubilité lors de l'utilisation iodures séparés. L'iode joue un rôle important dans le corps, se livrer à la production d'hormones de la thyroïde. 
Astate – un élément radioactif avec le numéro atomique 85 et le symbole A. Son oxydation possible indique -1, 1, 3, 5 et 7. Le seul halogène qui ne soit pas une molécule diatomique. Dans des conditions normales, un disque métallique matériau noir. Astate est un élément très rare, on sait si peu sur lui. En outre, astate a une demi-vie très courte, pas plus de quelques heures. Reçu en 1940 à la suite de la synthèse. On croit que astate semblable à l'iode. Caractérisé propriétés métalliques.
Le tableau ci-dessous montre la structure des atomes d'halogène, la structure de la couche externe d'électrons.
|
halogène |
La configuration de l'électron |
|
fluor |
1s 2 2s 2 2p 5 |
|
chlore |
2 3s 3p 5 |
|
brome |
3d 10 4s 2 4p 5 |
|
iode |
4d 10 5s 2 5p 5 |
|
astate |
4f 14 5d 10 6s 6p 2 5 |
Cette structure entraîne la couche externe d'électrons que les propriétés physiques et chimiques similaires aux halogènes. Cependant, lorsque l'on compare ces éléments et les différences observées.
groupe de propriétés périodiques d'halogène
Propriétés physiques des substances simples d'halogène changé avec l'augmentation du nombre ordinal de l'élément. Pour une meilleure absorption et une plus grande clarté, nous vous proposons quelques tables.
Les points de fusion et d'ébullition des augmentations de groupe avec la taille croissante de la molécule (F <Cl <Br <I <A). Cette augmentation signifie une augmentation de Van der Waals.
Tableau 1. Les halogènes. Propriétés physiques: fusion et point d'ébullition
|
halogène |
T de fusion (° C) |
Point d' ébullition T (° C) |
|
fluor |
-220 |
-188 |
|
chlore |
-101 |
-35 |
|
brome |
-7,2 |
58,8 |
|
iode |
114 |
184 |
|
astate |
302 |
337 |
- Les augmentations de rayon atomique.
la taille du noyau augmente (F <Cl <Br <I <A), car elle augmente le nombre de protons et de neutrons. De plus, chaque période ajoute de plus en plus les niveaux d'énergie. Cela conduit à des orbitales plus élevées et, par conséquent, à une augmentation du rayon de l'atome.
Tableau 2: halogène. Propriétés physiques: rayons atomiques
|
halogène |
Le rayon covalent (pm) |
Ion (X -) Plage (pm) |
|
fluor |
71 |
133 |
|
chlore |
99 |
181 |
|
brome |
114 |
196 |
|
iode |
133 |
220 |
|
astate |
150 |
- énergie d'ionisation diminue.
Si les électrons de valence externes ne sont pas situés à proximité du noyau, pour leur élimination ne nécessite pas beaucoup d'énergie de celui-ci. Ainsi, l'énergie nécessaire pour l'éjection de l'électron externe est pas si haut dans la partie inférieure d'un groupe d'éléments, comme il n'y a plus de niveaux d'énergie. En outre, l'ionisation de haute énergie provoque l'élément de montrer la qualité non métallique. propriétés métalliques, car l'énergie d'ionisation est réduite (A <I <Br <Cl <F) et l'iode affichage du astate.
Tableau 3. halogènes. Propriétés physiques: énergie d'ionisation
|
halogène |
L'énergie d'ionisation (kJ / mol) |
|
fluor |
1681 |
|
chlore |
1251 |
|
brome |
1140 |
|
iode |
1008 |
|
astate |
890 ± 40 |
- diminue électronégativité.
Le nombre d'électrons de valence dans un atome augmente avec l'augmentation des niveaux d'énergie à des niveaux progressivement inférieurs. Les électrons sont progressivement plus loin du noyau; Ainsi, le noyau et les électrons ne sont pas aussi attirés les uns aux autres. L'augmentation du dépistage là. Par conséquent électronégativité diminue avec l'augmentation de la période (A <I <Br <Cl <F).
Tableau 4. halogènes. Propriétés physiques: électronégativité
|
halogène |
électronégativité |
|
fluor |
4.0 |
|
chlore |
3.0 |
|
brome |
2.8 |
|
iode |
2,5 |
|
astate |
2.2 |
- affinité électronique diminue.
Étant donné que la taille d'un atome augmente avec le temps, l'affinité électronique est généralement réduite (B <I <Br <F <Cl). Exception – fluor, d'affinité qui est inférieure à celle du chlore. Ceci peut être expliqué par une taille plus petite par rapport au fluor et du chlore.
Tableau 5. électrons halogène Affinity
|
halogène |
affinité électronique (KJ / mol) |
|
fluor |
-328,0 |
|
chlore |
-349,0 |
|
brome |
-324,6 |
|
iode |
-295,2 |
|
astate |
-270,1 |
- éléments de réactivité diminue.
Réactivité d'halogène diminue avec l'augmentation période (A <I <Br <Cl <F). Cela est dû à l'augmentation du rayon de l'atome avec l'augmentation des niveaux d'énergie d'électrons. Cela réduit l'attraction des électrons de valence d'autres atomes réduisant la réactivité. Cette réduction se produit aussi en raison de la période tombant électronégativité augmente, ce qui réduit aussi l'attraction des électrons. En outre, avec la taille croissante de l'atome et la réduction du pouvoir oxydant.

chimie inorganique. Hydrogène + halogènes
Halide formé lorsque l'halogène est mis à réagir avec l'autre, moins électronégatif élément pour former un composé binaire. L'hydrogène réagit avec les halogènes pour former des halogénures de type HX:
- le fluorure d'hydrogène HF;
- HCl un chlorure;
- le bromure d'hydrogène HBr;
- l'iodure d'hydrogène HI.
des halogénures d'hydrogène sont facilement dissous dans l'eau pour former un halohydrique (fluorhydrique, chlorhydrique, bromhydrique, l'acide iodhydrique). Les propriétés de ces acides sont donnés ci-dessous.
Les acides formés par la réaction suivante: HX (aq) + H 2 O (l) → X – (aq) + H 3 O + (aq).
Tout halogénure d'hydrogène pour former un acide fort, à l'exception HF.
acidité augmente les acides halohydriques: HF <HCl <HBr <HI.
L'acide fluorhydrique peut graver le verre et certains fluorures inorganiques depuis longtemps.
Il peut sembler illogique que HF est le plus faible d'acide halohydrique, puisque le fluor lui-même a une grande électronégativité. Néanmoins liaison H-F est très forte, ce qui entraîne dans un acide très faible. Une relation étroite est définie par une courte longueur de la liaison et une grande énergie de dissociation. De tous les halogénures d'hydrogène HF a la longueur de la plus courte et la plus grande énergie de dissociation de liaison.
oxacides halogénés
Acides halogènes oxo sont des acides avec des atomes d'hydrogène, d'oxygène et un atome d'halogène. Leur acidité peut être déterminée en analysant la structure. oxacides halogènes sont présentés ci-dessous:
- L'acide hypochloreux, HOCl.
- HClO acide chloreux 2.
- l' acide chlorique HClO 3.
- l' acide perchlorique HClO 4.
- l'acide hypobromeux, HOBr.
- l' acide bromique, HBrO 3.
- l' acide perbromique HBrO 4.
- HOI acide hypoiodeux.
- HIO d'acide iodique 3.
- Metayodnaya acide HIO4, H5IO6.
Dans chacun de ces acides protoniques liés à l'atome d'oxygène, de sorte que la comparaison des longueurs de liaison des protons sont inutiles. Le rôle dominant est joué ici par électronégativité. acidité augmente avec le nombre d'atomes d'oxygène liés à l'atome central.
L'apparence et l'état de la matière
Les propriétés physiques de base des halogènes peuvent être brièvement exprimés dans le tableau suivant.
|
état de la substance (à la température ambiante) |
halogène |
apparence |
|
entreprise |
iode |
pourpre |
|
astate |
noir |
|
|
liquide |
brome |
feuille morte |
|
gazeux |
fluor |
jaune pâle brun |
|
chlore |
vert pâle |
apparence Explication
La couleur est un résultat d'halogènes absorption de la lumière visible par des molécules provoquant des électrons excités. Fluoro absorbe la lumière violette, et semble par conséquent jaune pâle. L'iode, en revanche, absorbe la lumière jaune et il semble violet (jaune et violet – couleurs complémentaires). couleur halogène devient plus sombre avec une période de plus en plus.

Les brome et d'iode solide liquide des récipients scellés sont en équilibre avec sa vapeur, qui peut être observé sous forme de gaz de couleur.
Bien que l'inconnu de astate couleur, on croit qu'il devrait être un iode plus sombre (t. E. Black) conformément à la tendance observée.
Maintenant, si on vous demandait: « Décrire les propriétés physiques des halogènes, » vous direz.
Le degré d'oxydation des atomes d'halogène dans les composés
Le degré d'oxydation est souvent utilisé au lieu de « valence des halogènes. » Typiquement, l'état d'oxydation égal à -1. Mais si l'halogène est lié à un autre oxygène ou halogène, il peut prendre d'autres états: l'oxygène -2 SB est prioritaire. Dans le cas de deux atomes d'halogène différents liés ensemble plus atome électronégatif prédomine et prend CO -1.
Par exemple, dans le chlorure d'iode (ICI) est CO chloro -1, +1 et l'iode. Le chlore est plus électronégatif que l'iode, par conséquent, le CO est égal à -1.
L'acide bromique (HBrO 4) de l' oxygène a un CO -8 (-2 x 4 = -8 atome). L'hydrogène a un nombre d'oxydation totale +1. L'addition de ces deux valeurs donne CO -7. Etant donné que le composé final SB doit être égale à zéro, le CO est de sept brome.
La troisième exception à cette règle est le degré d'oxydation de l'halogène sous la forme élémentaire (X 2), où le CO est égal à zéro.
|
halogène |
Dans les composés de CO |
|
fluor |
-1 |
|
chlore |
-1, 1, 3, 5, 7 |
|
brome |
-1, +1, +3, +4, +5 |
|
iode |
-1, 1, 5, 7 |
|
astate |
-1, 1, 3, 5, 7 |
Pourquoi le fluor est toujours -1?
Électronégativité augmente avec le temps. Par conséquent, le fluor a le plus électronégativité de tous les éléments, comme en témoigne sa position dans le tableau périodique. Sa configuration électronique 1s 2 2s 2 2p 5. Si le fluor obtient un autre électron, extrême p orbitals sont complètement remplis et forment un octet complet. Parce que le fluor a une électronégativité élevée, il peut facilement sélectionner un électron d'un atome de voisins. Le fluor dans ce cas isoélectronique gaz inerte (avec huit électrons de valence) et l'ensemble de ses orbitales externes remplis. Dans cet état, le fluor est beaucoup plus stable.
La préparation et l'utilisation des halogènes
Dans la nature, les atomes d'halogène sont à l'anion, de sorte que l'halogène libre est produit par oxydation par électrolyse ou par des oxydants. Par exemple, le chlore est produit par hydrolyse d'une solution de chlorure de sodium. L'utilisation d'halogènes et de leurs composés divers.
- Le fluorure. Malgré le fait que le fluor est très réactif, il est utilisé dans de nombreuses industries. Par exemple, il est un élément clé de polytétrafluoroéthylène (PTFE) et d'autres polymères fluorés. Les chlorofluorocarbones sont organiques des produits chimiques qui ont été précédemment utilisés comme réfrigérants et d' agents propulseurs dans des aérosols. Leur application a été arrêtée en raison de leur impact possible sur l'environnement. Ils ont été remplacés par des hydrochlorofluorocarbones. Fluor est ajouté à la pâte dentifrice (SnF 2) et de l' eau potable (NAF) pour prévenir la carie dentaire. L'halogène est contenu dans l'argile utilisée pour produire certains types de céramiques (LIF), utilisés dans les centrales nucléaires (UF 6) pour obtenir un antibiotique fluoroquinolone, l' alumine (Na 3 AlF 6) pour l' isolation de l' équipement à haute tension (SF 6).
- Le chlore trouverez également une variété d'utilisations. Il est utilisé pour la désinfection de l'eau potable et des piscines. L' hypochlorite de sodium (NaClO) est le principal composant des agents de blanchiment. L'acide chlorhydrique est largement utilisé dans l'industrie et les laboratoires. Le chlore présent dans le chlorure de polyvinyle (PVC) et d'autres polymères qui sont utilisés pour les fils d'isolation, des tubes et de l'électronique. En outre, le chlore a été utile dans l'industrie pharmaceutique. Medicaments contenant du chlore, sont utilisés pour traiter les infections, les allergies et le diabète. sous forme de chlorhydrate neutre – un composant de nombreux médicaments. Le chlore est également utilisé pour stériliser le matériel hospitalier et la désinfection. Dans l'agriculture, le chlore est un composant de nombreux pesticides commerciaux DDT (dihlorodifeniltrihloretan) a été utilisé comme insecticide agricole, mais son utilisation a été interrompue.

- Bromine, en raison de son ininflammabilité, utilisé pour inhiber la combustion. Il contient également du bromure de méthyle, un pesticide utilisé pour le stockage de récoltes et de suppression des bactéries. Cependant, l'utilisation excessive de bromure de méthyle a été abandonné en raison de son impact sur la couche d'ozone. Le brome est utilisé dans la production d'essence, film photographique, les extincteurs, les médicaments pour le traitement de la pneumonie et la maladie d'Alzheimer.
- L' iode joue un rôle important dans le bon fonctionnement de la glande thyroïde. Si le corps ne reçoit pas assez d'iode, la glande thyroïde augmente. Pour la prévention du goitre halogène actif ajouté au sel de table. L'iode est également utilisé comme un antiseptique. L'iode est contenue dans les solutions utilisées pour la purification des plaies ouvertes et aussi en pulvérisations désinfectantes. De plus, l'iodure d'argent est important dans l'image.
- Astate – halogène radioactif de terre rare et, de manière plus est pas utilisé. On croit que cet élément peut aider à l'iode dans la régulation des hormones thyroïdiennes.















