Tout autour de nous le monde est composé de petites, imperceptible à l'oeil des particules. Électrons – c'est l'un d'entre eux. Leur découverte a eu lieu relativement récemment. Et il a ouvert une nouvelle compréhension de la structure de l'atome, les mécanismes de transmission d'électricité et la structure du monde dans son ensemble.
Comment diviser l'indivisible
La compréhension moderne des électrons – ce particules élémentaires. Ils sont cohérents et ne sont pas divisés en plus petites structures. Mais une telle idée n'a pas toujours existé. Jusqu'à 1897 sur les électrons avaient aucune idée.
Plus anciens penseurs Grèce devinaient que chaque élément de la lumière, le bâtiment est constitué d'une pluralité de « briques » microscopiques. La plus petite unité de matière a ensuite examiné l'atome, et cette croyance a persisté pendant des siècles.
La représentation de l'atome a changé qu'à la fin du XIXe siècle. Après enquête J. Thomson, E. Rutherford, H. Lorenz, P. Zeeman particules les plus petites noyaux atomiques indivisibles et électrons ont été reconnus. Au fil du temps, on a découvert des protons, des neutrons, et même plus tard – le neutrino, kaons, etc …, pions
Maintenant, la science connaît un grand nombre de particules élémentaires, le lieu dont invariablement occupé et électrons.

La découverte d'une nouvelle particule
Au moment où ils étaient des électrons découverts dans l'atome, les scientifiques connaissent depuis longtemps l'existence de l' électricité et le magnétisme. Mais la vraie nature et les propriétés complètes de ces phénomènes sont encore un mystère, qui occupe l'esprit de nombreux physiciens.
il était connu au début du XIXe siècle que la propagation du rayonnement électromagnétique, la vitesse de la lumière. Cependant, l'Anglais Dzhozef Tomson, mener des expériences avec des rayons cathodiques, a conclu qu'ils sont constitués de nombreux petits grains dont la masse est inférieure à nucléaire.

En Avril 1897 Thomson a prononcé un discours où il a présenté la communauté scientifique à la naissance d'une nouvelle particule dans la composition des atomes, qu'il a appelé corpuscule. Plus tard, Ernest Rutherford en utilisant des expériences de fleuret a confirmé les conclusions de son maître, et les corpuscules a donné un autre nom – « électrons ».
Cette découverte a conduit le développement de la science non seulement physique, mais aussi chimique. Il est possible de réaliser des progrès significatifs dans l'étude de l'électricité et le magnétisme, les propriétés de la matière, et a donné lieu à la physique nucléaire.
Qu'est-ce qu'un électron?
Electrons – est le plus léger des particules ayant une charge électrique. Notre connaissance d'entre eux restent encore largement contradictoires et incomplètes. Par exemple, dans les idées modernes ils vivent à jamais, parce que jamais rompre, à la différence des neutrons et des protons (effondrement théorique du dernier âge dépasse l'âge de l'univers).
Les électrons sont stables et ont une charge négative constante e = 1,6 x 10 -19 Cl. Ils appartiennent à la famille du groupe fermions et leptons. Les particules impliquées dans une faible interaction électromagnétique et gravitationnelle. Ils sont composés d'atomes. Les particules qui ont perdu le contact avec les atomes – électrons libres.
La masse des électrons est de 9,1 x 10 -31 kg et est 1836 fois inférieure à la masse d'un proton. Ils ont une demi-intégrale et de spin et un moment magnétique. Électronique indiquée par la lettre « e – ». La même chose, mais avec un signe plus indique son antagoniste – positons antiparticule.
État des électrons dans un atome
Quand il est devenu clair qu'un atome est composé de petites structures, il était nécessaire de comprendre exactement comment ils sont disposés en elle. Ainsi, à la fin du XIXe siècle est apparu le premier modèle de l'atome. Selon le modèle planétaire, des protons (chargés positivement) et les neutrons (neutres) constituent le noyau. A des électrons se déplaçant dans des orbites elliptiques.
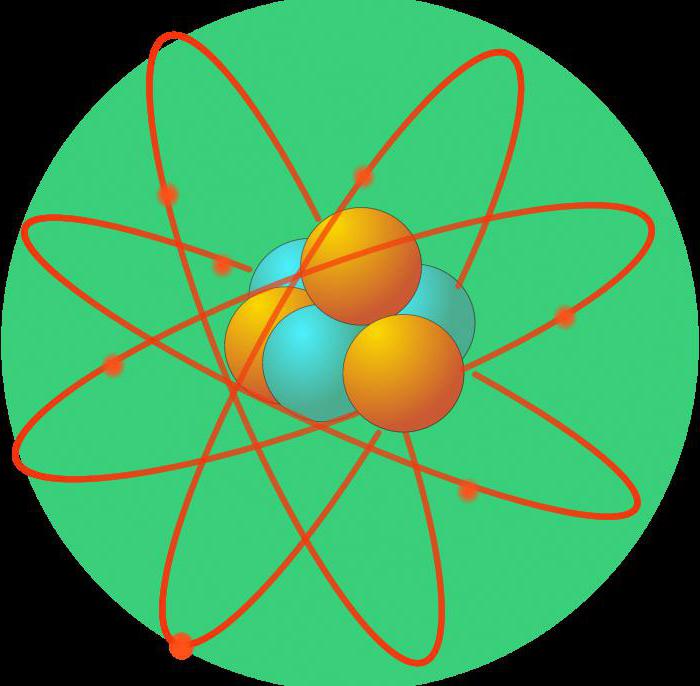
Ces perceptions changent avec l'avènement de la physique quantique au début du XX siècle. De Broglie lui a présenté la théorie selon laquelle l'électron se comporte non seulement comme une particule, mais aussi comme une vague. Erwin Schrodinger crée un modèle d'onde de l'atome, où les électrons sont représentés par un nuage avec une certaine densité de charge.

Pour déterminer l'emplacement et la trajectoire des électrons autour du noyau est pratiquement impossible. À cet égard, introduit un terme spécial « orbitale » ou « nuage électronique », qui est l'espace des endroits les plus probables desdites particules.
les niveaux d'énergie
Le nuage d'électrons autour d'un atome tout autant et protons dans son noyau. Tous sont à des distances différentes. Le plus proche du noyau sont disposés des électrons avec le moins d'énergie. Plus l'énergie est dans les particules, plus ils peuvent être.
Mais ils ne sont pas disposés au hasard, et de prendre des niveaux spécifiques, qui peuvent accueillir seulement un certain nombre de particules. Chaque niveau a sa propre quantité d'énergie et est divisé en sous-niveaux, et ceux-ci, à son tour, sur les orbitals.
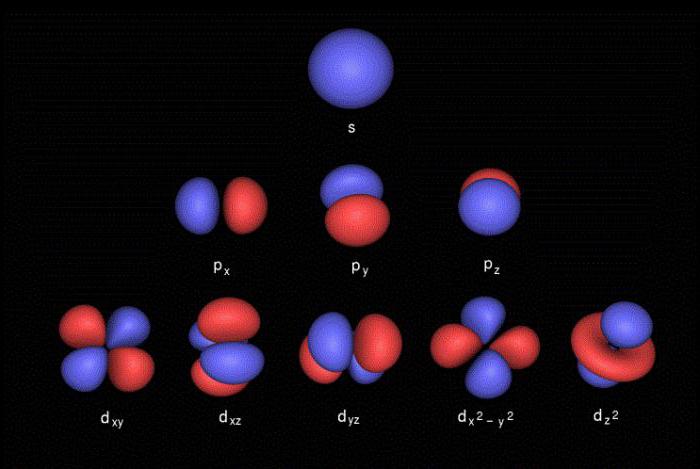
Décrire les caractéristiques et la localisation des électrons aux niveaux d'énergie, quatre nombres quantiques :
- n – le nombre entier spécifiant principale réserve d'énergie d'électrons (correspond au nombre de la période d'élément chimique);
- l – Numéro orbital, qui décrit la forme du nuage d'électrons (s – sphérique, p – forme de huit, d – la forme de trèfle ou double huit, f – une forme géométrique complexe);
- m – nombre d'orientation de nuage magnétique définissant dans un champ magnétique;
- ms – le nombre de spin, qui caractérise l'orbite des électrons autour de son axe.
conclusion
Ainsi, les électrons – une écurie, des particules chargées négativement. Ils sont simples et ne peuvent se désintégrer en d'autres éléments. Ils sont désignés en tant que particules fondamentales, à savoir ceux qui font partie de la structure de la matière.
Les électrons se déplacent autour des noyaux et forment leur coquille d'électrons. Ils affectent les produits chimiques, optiques, propriétés mécaniques et magnétiques de diverses substances. Ces particules sont impliquées dans l'interaction électromagnétique et gravitationnelle. Leur mouvement directionnel crée un champ de courant électrique et magnétique.









