Molecule: un poids molécule. La taille et la masse des molécules
La composition de matériaux complexes, même si elles sont formées par des particules minuscules – atomes, des molécules, des ions. La structure moléculaire a beaucoup de liquides et de gaz, ainsi que certains corps solide. Les atomes et les ions comprennent des métaux, de nombreux sels. Toutes les particules ont une masse, même la plus petite molécule. Masse de la molécule, si nous exprimons dans Kilos, reçoit une valeur très faible. Par exemple, m (H 2 O) = 30 • 10 -27 kg. De telles caractéristiques importantes d'une substance comme le poids et les dimensions des microparticules, a été étudié physiciens et des chimistes longtemps. Les fondations ont été posées dans les œuvres de Mikhail Lomonosov et Dzhona Daltona. Voyez comment changé depuis des vues sur le microcosme.
Présentation à l'Université de « corpuscules »
L'hypothèse de la discrète structure de la matière exprimée par les savants de la Grèce antique. Ensuite, il a été donné le nom de « atome » la plus petite particule indivisible des corps, « blocs de construction » de l'univers. Le grand savant russe M. V. Lomonosov a écrit sur les moyens physiques négligeable et indivisible structure des particules de la matière – corpuscule. Plus tard, dans les écrits d'autres savants, elle a été nommée « molécule ».
molécule de masse et ses dimensions sont déterminées par les propriétés de ses atomes constituants. Pour un longtemps, les scientifiques ont pas été en mesure de regarder plus profondément dans le microcosme qui a empêché le développement de la chimie et de la physique. Lomonosov exhorté à plusieurs reprises collègues d'apprendre et dans leur travail basé sur des données quantitatives précises – une « mesure et le poids. » Grâce au travail de chimiste russe et physicien a jeté les bases de la doctrine de la structure de la matière, qui sont devenus partie intégrante de la théorie atomique moléculaire cohérente.

Atomes et molécules – « blocs de construction de l'univers »
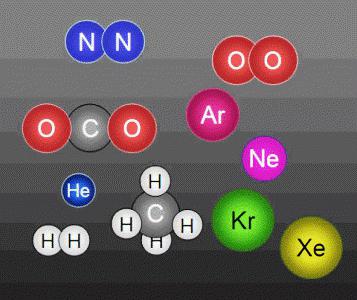
Même les objets microscopiques difficiles à trouver, ils ont des propriétés différentes. Les particules tels que des atomes formés par le noyau et les couches électroniques diffèrent par le nombre de charges positives et négatives de rayon poids. Atomes et des molécules existent dans la composition de substances, non pas isolément, ils sont attirés par une force différente. effet plus notable des forces d'attraction dans les solides, plus faible – dans les liquides, à peine sentir dans les substances gazeuses.
Les réactions chimiques ne sont pas accompagnés par des atomes de destruction. Le plus souvent, il y a un regroupement d'entre eux, il y a une autre molécule. molécule de masse dépend de ce que les atomes il est formé. Mais avec tous les changements dans les atomes sont chimiquement indivisibles. Mais ils peuvent faire partie des molécules différentes. Les atomes conservent les propriétés de l'élément auquel la. Molécule avant de se désintégrer en atomes conserve tous les attributs de la substance.
structure des corps microparticule – la molécule. masse de la molécule
Pour mesurer les dispositifs macrobodies de masse sont utilisés, dont le plus ancien – échelles. Le résultat de mesure est commodément préparé en kilogrammes, comme unité de base de grandeurs physiques du système international (SI). Pour déterminer la masse moléculaire en kilogrammes, il est nécessaire de fixer leurs poids atomiques en fonction du nombre de particules. Pour plus de commodité, une unité spéciale de masse a été introduit – nucléaire. Vous pouvez l'écrire sous la forme d'abréviations de lettre (AMU). Cette unité correspond à un douzième de la masse du nucléide de carbone 12 C.
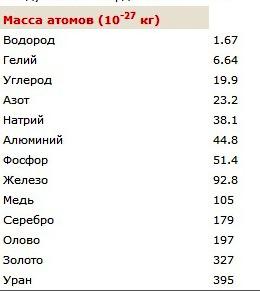
Si nous exprimons la valeur trouvée en unités standard, on obtient 1,66 • 10 -27 kg. Ces petits indicateurs pour les corps de masse fonctionnent principalement la physique. L'article est une table à partir de laquelle vous pouvez apprendre quelles sont les masses des atomes de certains éléments chimiques. Pour savoir quelle est la masse d'une molécule d'hydrogène en kilogrammes, il faut multiplier par deux le montre le tableau de la masse atomique de l'élément chimique. Le résultat est une molécule de valeur de poids se composent de deux atomes.
masse moléculaire relative
Il est difficile d'opérer dans le calcul des quantités très petites, il est peu pratique, conduit à temps, sujette aux erreurs. En ce qui concerne le poids des microparticules, puis la libération de la situation difficile a été l'utilisation des valeurs relatives. Familier pour les chimistes terme se compose de deux mots – « masse atomique », son symbole – Ar. conception identique a été introduit à la masse moléculaire (la même que la masse de la molécule). La formule concernant les deux quantités: Mr = m (cible) / 12.01 m (12 C).
Souvent, vous pouvez entendre ce qu'ils disent « poids moléculaire. » Ce terme obsolète utilisé même par rapport au poids moléculaire, mais moins fréquemment. Le fait que le poids – il est une grandeur physique différente – dont la puissance dépend des coordonnées géographiques du corps. En revanche, la masse est une constante caractéristique des particules qui participent à des processus chimiques, et sont déplacés à vitesse normale.

Comment déterminer le poids moléculaire
La définition exacte du poids molécule est portée par l'instrument – spectromètre de masse. Pour résoudre les problèmes, vous pouvez utiliser les informations du tableau périodique. Par exemple, la masse d'une molécule d'oxygène est 2 • 16 = 32. Nous effectuons des calculs simples et de trouver la valeur de M. (H 2 O) – poids moléculaire relative de l' eau. Par tableau périodique est défini que la masse d'oxygène – 16, l'atome d' hydrogène – 1. Dessiner des calculs simples: M r (H 2 O) = 1 + 2 • 16 = 18, M r – poids moléculaire, H 2 O – molécule d'eau, H – élément de symbole hydrogène O – connexion d'oxygène chimique.
masses des isotopes
éléments chimiques dans la nature et la technologie existent plusieurs espèces d'atomes – isotopes. Chacun d'eux a un poids individuel, sa valeur ne peut pas être une valeur décimale. Cependant, le poids atomique de l'élément chimique est souvent un certain nombre de multiples signes après la virgule. Lorsque les calculs tiennent compte de la prévalence de chaque espèce dans la croûte terrestre. Par conséquent, la masse des atomes dans le tableau périodique ne sont pas nécessairement des nombres entiers. L'utilisation de ces valeurs pour les calculs, nous obtenons la masse des molécules, qui sont également pas des entiers. Dans certains cas, il peut être une valeur d'arrondi.
Le poids moléculaire de la structure non-moléculaire de la matière
La plupart des composés inorganiques ne sont pas la structure moléculaire. Les métaux sont composés d'atomes, des ions et des électrons libres, des sels – de cations et d'anions. Pour les substances de poids structures moléculaires non comptées également des molécules conditionnelles de formule brute, ce qui reflète la structure la plus simple. Nous trouvons la valeur Mr pour la structure des substances ioniques – sel dont la formule NaCl. M r = 23 + 35,5 = 55,5. Pour certains types de calculs requis masse moléculaire de l'air – mélange gazeux. Compte tenu du pourcentage des différentes substances dans l'atmosphère, le moléculaire massique de l'air est de 29.
La taille et la masse des molécules
Les micrographies électroniques de grandes molécules peuvent considérer les atomes individuels, mais ils sont si petits qu'un microscope ordinaire ne peut pas être vu. la taille des particules d'une substance linéaire comme le poids, – une constante caractéristique. Le diamètre de la molécule dépend des rayons de ses atomes constituants, leur attraction mutuelle. Les tailles de particules varient en fonction du nombre de protons et les niveaux d'énergie. un atome d'hydrogène – le plus petit en taille, son rayon est seulement 0,5 • 10 -8 cm atome d'uranium est trois fois plus d' atomes d'hydrogène .. Ces « géants » du microcosme – les molécules de substances organiques. Ainsi, une de la dimension linéaire de la particule protéique est de 44 • 10 -8 cm.
Pour résumer: la masse de molécules – est la somme des masses des atomes qui les composent. La valeur absolue en kg peut être obtenue en multipliant le poids moléculaire trouvés dans le Tableau Périodique, la quantité 1,66 • 10 -27 kg.
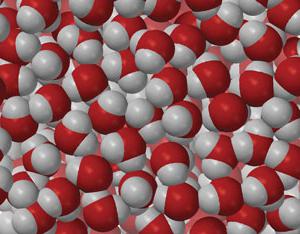
Les molécules sont négligeables par rapport aux macro-organismes. Par exemple, la taille de la molécule d'eau H 2 O donne la pomme autant de fois, combien de fois ce fruit est plus petit que notre planète.