Comment se situent les particules dans les solides, les liquides et les gaz?
Ce matériau indique non seulement comment les particules sont disposées en solides, mais aussi comment elles se déplacent dans des gaz ou dans des liquides. Les types de réseaux cristallins dans diverses substances seront également décrits.
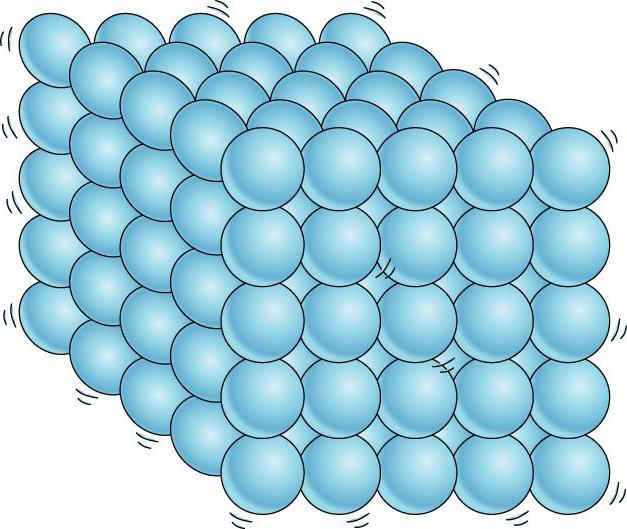
Etat agrégé
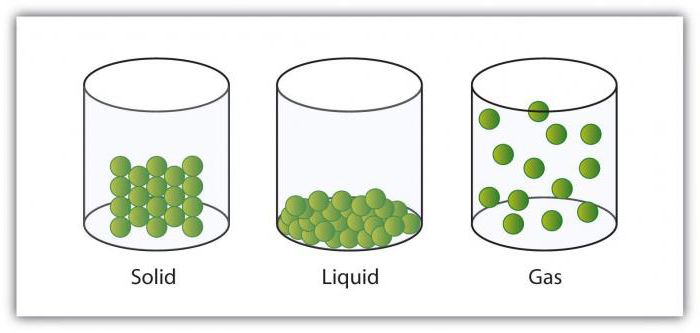
Il existe certaines normes qui indiquent la présence de trois états globaux typiques, à savoir: solides, liquides et gazeux.
Définissez les composants pour chaque état agrégé.
- Les solides sont pratiquement stables en volume et en forme. Ce dernier changement est extrêmement problématique sans coûts énergétiques supplémentaires.
- Le liquide peut facilement changer de forme, mais conserve encore son volume.
- Les substances gazeuses ne contiennent pas de forme ni de volume.
Le critère principal par lequel l'état agrégé est déterminé est l'emplacement des molécules et les voies de leur mouvement. Dans une substance gazeuse, la distance minimale entre les molécules individuelles est beaucoup plus grande qu'eux-mêmes. À leur tour, les molécules de substances liquides ne se dispersent pas sur de longues distances dans les conditions habituelles pour elles et conservent leur volume. Les particules actives dans les solides sont disposées dans un ordre strictement défini, chacune d'elles, comme une pendule, se déplace autour d'un certain point dans le réseau cristallin. Cela donne aux solides une force et une rigidité particulières.
Par conséquent, dans ce cas, la question la plus pertinente est la façon dont les particules actives sont situées dans des solides. Dans tous les autres cas, les atomes (molécules) n'ont pas une telle structure ordonnée.
Caractéristiques du fluide
Il est nécessaire d'accorder une attention particulière au fait que les liquides sont une sorte de liaison intermédiaire entre l'état solide du corps et sa phase gazeuse. Ainsi, à mesure que la température est abaissée, le liquide se solidifie et, lorsqu'il augmente plus haut que le point d'ébullition de la substance, passe dans un état gazeux. Cependant, le liquide présente des caractéristiques communes avec des substances solides et gazeuses. Ainsi, en 1860, l'éminent scientifique national DI Mendeleyev a établi l'existence de la soi-disant température critique – ébullition absolue. C'est une valeur à laquelle la limite mince entre le gaz et la matière à l'état solide disparaît.
Le prochain critère, qui combine deux états agrégés voisins, est l'isotropie. Dans ce cas, leurs propriétés sont les mêmes dans toutes les directions. Les cristaux, à leur tour, sont anisotropes. Comme les gaz, les liquides n'ont pas une forme fixe et occupent tout le volume du navire dans lequel ils se trouvent. C'est-à-dire qu'ils ont une faible viscosité et une grande fluidité. Face à l'autre, les microparticules liquides ou gazières font des mouvements libres. Il s'agissait plutôt que dans le volume occupé par le liquide, il n'y a pas de mouvement moléculaire ordonné. Ainsi, le liquide et le gaz étaient opposés aux cristaux. Mais à la suite d'études ultérieures, la similitude entre les corps solides et liquides a été prouvée.
Dans la phase liquide à une température proche de la solidification, le mouvement thermique ressemble au mouvement dans les solides. Dans ce cas, le liquide peut encore avoir une certaine structure. Par conséquent, lorsque nous répondons à la question de savoir comment les particules sont disposées dans les solides dans les liquides et les gaz, on peut dire que dans ce dernier cas, le mouvement des molécules est chaotique, désordonné. Mais, dans les molécules solides, occupent dans la plupart des cas une position définie et fixe.
Le fluide est une sorte d'élément intermédiaire. Et plus la température est proche de l'ébullition, plus les molécules se déplacent comme dans les gaz. Si la température est plus proche de la transition vers la phase solide, les microparticules commencent à se déplacer de plus en plus en ordre.

Changement dans l'état des substances
Considérons l'exemple le plus simple d'un changement dans l'état de l'eau. La glace est une phase solide d'eau. Sa température est inférieure à zéro. À une température de zéro, la glace commence à fondre et se transforme en eau. Cela s'explique par la destruction du réseau cristallin: lorsqu'il est chauffé, les particules commencent à se déplacer. La température à laquelle la substance modifie l'état global est appelée point de fusion (dans notre cas, il est 0 pour l'eau). Notez que la température de la glace restera à un niveau jusqu'à ce qu'il se fond complètement. Dans ce cas, les atomes ou les molécules du liquide se déplacent de la même manière que dans les solides.
Ensuite, nous continuerons à chauffer l'eau. Les particules commencent à se déplacer plus intensément jusqu'à ce que notre substance atteigne le point suivant du changement dans l'état agrégé, le point d'ébullition. Un tel moment se produit lorsque les liens entre les molécules qui le forment sont interrompus en raison de l'accélération du mouvement, alors il acquiert un caractère libre et le liquide considéré passe dans la phase gazeuse. Le processus de transformation d'une substance (eau) d'une phase liquide à une gazeuse est appelé ébullition.
La température à laquelle l'eau bouillonne est appelée point d'ébullition. Dans notre cas, cette valeur est égale à 100 degrés Celsius (la température dépend de la pression, la pression normale est d'une atmosphère). Remarque: jusqu'à ce que le liquide existant se transforme complètement en vapeur, sa température reste constante.
Il est également possible d'inverser le processus de transfert d'eau d'un état gazeux (vapeur) à un liquide, appelé condensation.
Ensuite, vous pouvez observer le processus de congélation – le processus de transition d'un liquide (eau) dans une forme solide (l'état initial est décrit ci-dessus est de la glace). Les procédés décrits ci-dessus permettent d'obtenir une réponse directe à la façon dont les particules sont disposées dans des solides, dans des liquides et des gaz. L'emplacement et l'état des molécules d'une substance dépend de son état agrégé.
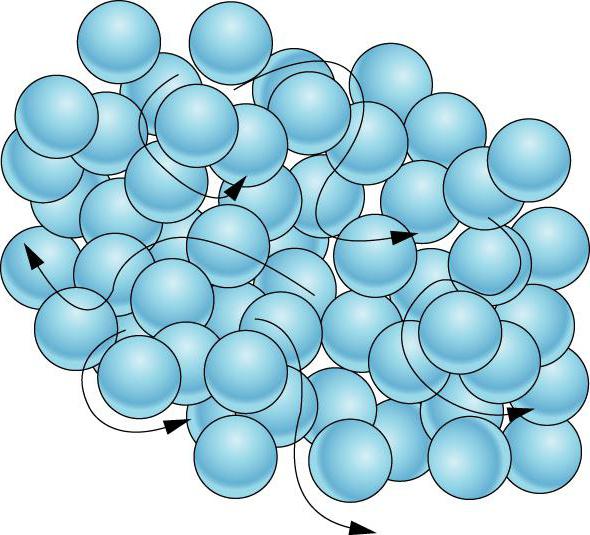
Qu'est-ce qu'un corps solide? Comment les microparticules se comportent-elles?
Un corps solide est un état d'un milieu matériel dont la caractéristique distincte est la préservation de la forme constante et la nature constante du mouvement thermique des microparticules, qui effectuent des fluctuations insignifiantes. Les corps peuvent être dans un état solide, liquide et gazeux. Il y a aussi le quatrième état, que les scientifiques modernes ont tendance à attribuer au nombre d'agrégats – c'est ce qu'on appelle le plasma.
Ainsi, dans le premier cas, toute substance, en règle générale, a une forme inchangée constante, et cela a un effet clé sur la façon dont les particules sont disposées dans des solides. Au niveau microscopique, on constate que les atomes qui forment un solide sont reliés les uns aux autres par des liaisons chimiques et sont situés aux noeuds du réseau cristallin.
Mais il y a une exception – les substances amorphes qui sont à l'état solide, mais la présence d'un réseau cristallin ne peut se vanter. C'est à partir de cela que nous pouvons répondre à la question de savoir comment les particules sont disposées en solides. La physique dans le premier cas indique que les atomes ou les molécules se trouvent dans les sites en treillis. Mais dans le second cas, il n'y a certainement pas de telles commandes, et une telle substance ressemble plus à un liquide.
La physique et la structure possible d'un solide
Dans ce cas, la substance tend à maintenir son volume et, bien sûr, sa forme. C'est-à-dire, afin de changer ce dernier, il faut faire des efforts, et peu importe qu'il s'agisse d'un objet métallique, d'un plastique ou d'une plasticine. La raison en est dans sa structure moléculaire. Et plus précisément, dans l'interaction des molécules, dont le corps se compose. Dans ce cas, ils se situent le plus près. Cette disposition des molécules est de nature récurrente. C'est pourquoi les forces d'attraction mutuelle entre chacun de ces composants sont très importantes.
L'interaction des microparticules explique la nature de leur mouvement. La forme ou le volume d'un tel corps solide est difficile à corriger dans un sens ou dans l'autre. Les particules d'un corps solide sont incapables de se déplacer de manière aléatoire tout au long du volume d'un solide, mais elles peuvent seulement osciller à proximité d'un certain point de l'espace. Les molécules du solide fluctuent de façon chaotique dans des directions différentes, mais elles rencontrent celles qui les renvoient à leur état d'origine. C'est pourquoi les particules solides se situent, en règle générale, dans un ordre strictement défini.
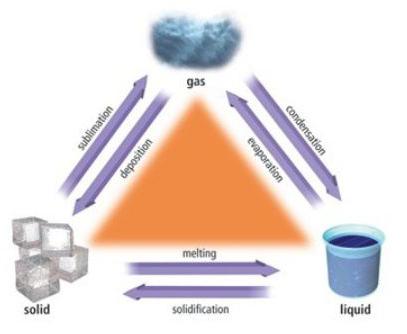
Les particules et leur emplacement dans un solide
Les corps solides peuvent être de trois types: cristallins, amorphes et composites. C'est la composition chimique qui affecte l'agencement des particules dans les solides.
Les solides cristallins ont une structure ordonnée. Leurs molécules ou leurs atomes forment un réseau spatial cristallin de forme régulière. Ainsi, un corps solide à l'état cristallin possède un réseau cristallin défini qui définit à son tour certaines propriétés physiques. C'est la réponse à la façon dont les particules sont disposées dans un solide.
Permettez-nous de donner un exemple: il y a de nombreuses années à Saint-Pétersbourg, un stock de boutons d'étain blanc brillant a été stocké dans l'entrepôt, qui, lorsque la température a été abaissée, a perdu son lustre et s'est transformé de blanc en gris. Les boutons étaient dispersés dans une poudre grise. La «peste en étain» – la soi-disant «maladie», mais en fait, c'était une restructuration de la structure cristalline sous l'influence de la basse température. L'étain lors de la transition de la variété blanche aux crumelles grises en poudre. Les cristaux, à leur tour, sont divisés en mono- et polycristaux.
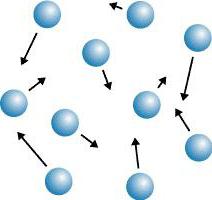
Cristaux simples et polycristaux
Les monocristaux (sel de table) sont des cristaux homogènes homogènes représentés par un réseau cristallin continu sous forme de polygones réguliers. Les polycristaux (sable, sucre, métaux, pierres) sont des corps cristallins qui se sont développés à partir de petits cristaux disposés chaotiquement. Dans les cristaux, un phénomène tel que l'anisotropie est observé.
Amorphe: un cas spécial
Les corps amorphes (résine, colophane, verre, ambre) n'ont pas d'ordre strictement strict dans l'agencement des particules. Il s'agit d'un cas non standard de l'ordre dans lequel les particules sont solides. Dans ce cas, le phénomène de l'isotropie est observé, les propriétés physiques des corps amorphs sont les mêmes dans toutes les directions. À des températures élevées, ils deviennent des liquides visqueux, et à basse température, ils sont similaires aux solides. Lorsqu'ils sont exposés à des effets externes, ils présentent simultanément des propriétés élastiques, c'est-à-dire qu'ils se séparent en particules miniatures comme les corps solides et la fluidité: ils commencent à couler comme liquides sous des effets de température prolongés. Ils n'ont pas de température définie de fusion et de cristallisation. Lorsqu'ils sont chauffés, les corps amorphs se ramollissent.
Exemples de substances amorphes
Prenez, par exemple, le sucre ordinaire et découvrez l'agencement des particules solides dans divers cas par exemple. Dans ce cas, le même matériau peut se produire sous forme cristalline ou amorphe. Si le sucre fondu gèle lentement, les molécules forment des rangées même – des cristaux (sucre ou sucre granulé). Si le sucre fondu, par exemple, verser dans de l'eau froide, le refroidissement se produira très rapidement, et les particules n'ont pas le temps de former les rangées correctes – la fonte durcit sans former de cristaux. Il en résulte des bonbons au sucre (c'est le sucre non cristallisé).
Mais après un certain temps, une telle substance peut recristalliser, les particules sont collectées dans les rangées de droite. Si le bonbon sucré se couche pendant plusieurs mois, il commencera à être recouvert d'une couche lâche. Apparaissent donc à la surface des cristaux. Pour le sucre, la période sera de plusieurs mois, et pour la pierre – des millions d'années. Un exemple unique est le carbone. Le graphite est un carbone cristallin, sa structure est en couches. Un diamant est le minéral le plus dur de la terre, capable de découper du verre et de scier des pierres, il est utilisé pour le forage et le polissage. Dans ce cas, la substance est un carbone, mais la fonctionnalité est la capacité de former différentes formes cristallines. C'est une autre réponse à la façon dont les particules sont disposées dans un solide.
Résultats. Conclusion
La structure et l'agencement des particules dans les solides dépendent du type de substance à laquelle appartient la substance. Si la substance est cristalline, l'agencement des microparticules sera commandé. Les structures amorphes ne possèdent pas une telle caractéristique. Mais les composites peuvent appartenir au premier et au deuxième groupe.
Dans un cas, le liquide se comporte de manière similaire à un solide (à une température basse proche de la température de cristallisation), mais il peut également agir comme un gaz (à mesure qu'il s'élève). Par conséquent, dans ce matériel de revue, nous avons examiné comment les particules se situent non seulement en solides, mais aussi dans d'autres états globaux de base de la matière.