azote des composés. propriétés d'azote
Donner naissance au nitrate – traduit du mot latin Nitrogenium. Cet azote titre – élément chimique avec un numéro atomique de 7, la tête du groupe 15 ème dans la version longue du tableau périodique. Sous la forme d'une substance simple composée de la terre distribuée air bag – atmosphère. Une variété de composés azotés dans la croûte terrestre, et les organismes vivants sont largement utilisés dans les industries, les militaires, l'agriculture et la médecine.
Pourquoi l'azote appelé « étouffement » et « sans vie »
Comme les historiens de la chimie ont obtenu cette première suggèrent substance simple Henry Cavendish (1777). Scientific air passe sur des braises pour l'absorption des produits de réaction en utilisant un alcali. En raison de chercheur expérience trouvé gaz incolore et inodore, le charbon n'a pas réagi. Cavendish a appelé « l'air suffocant » pour l'incapacité de maintenir la respiration et la combustion.
Chimique moderne explique que l'oxygène est amené à réagir avec du charbon, du dioxyde de carbone est formé. Le reste « étouffant » de l'air est pour l'essentiel des molécules de N 2. Cavendish et d'autres scientifiques à l'époque à ce sujet ne sont pas encore connus, bien que les composés azotés et de nitrate ont ensuite été largement utilisés dans l'économie. Le scientifique a parlé du gaz inhabituel à un collègue de mener des expériences similaires – Joseph Priestley.
En même temps, Carl Scheele attire l'attention sur la composante inconnue de l'air, mais n'a pas expliqué correctement son origine. Seul Daniel Rutherford en 1772 a réalisé que les expériences actuelles « suffocante » « gâté » gaz – azote. Certains scientifiques pensent que son découvreur – il est encore débat des historiens de la science.

15 ans après les expériences de Rutherford célèbre chimiste Antuan Lavuaze a proposé de remplacer l'air terme « gâté » fait référence à l'azote, de l'autre – Nitrogenium. Au moment où il a été prouvé que cette substance ne brûle pas, ne supporte pas la respiration. Ensuite, il y avait le nom russe « azote », ce qui est interprété de différentes manières. disent souvent que le terme signifie « sans vie ». Des études ultérieures ont réfuté la croyance largement répandue sur les propriétés des substances. Les composés azotés – protéines – les grandes macromolécules dans la composition des organismes vivants. Afin de construire les plantes absorbent du sol nutrition minérale éléments nécessaires – 2- ions NO 3 et NH 4 +.
Azote – un élément chimique
Pour comprendre la structure atomique et les propriétés aide le système périodique (PS). La position de l'élément chimique dans le tableau périodique peut définir la charge nucléaire, le nombre de protons et de neutrons (nombre de masse). Il est nécessaire de prêter attention à la valeur de la masse atomique – c'est l'une des principales caractéristiques de l'élément. période, le nombre correspond au nombre de niveaux d'énergie. La version courte du numéro de groupe de tableau périodique correspond au nombre d'électrons du niveau de energaticheskom externe. Pour résumer les données dans les caractéristiques générales de l'azote par sa position dans le système périodique:
- Ceci est un élément non métallique se trouve dans le coin supérieur droit de la SS.
- Symbole chimique: N.
- Numéro du logement: 7.
- Masse atomique relative: 14,0067.
- Formule composés à hydrogène volatils: NH 3 (ammoniac).
- Forme un oxyde supérieur N 2 O 5, qui est égal à la valence de l' azote V.
Structure atome d'azote:
- charge nucléaire 7.
- Le nombre de protons: 7; le nombre de neutrons: 7.
- Nombre de niveaux d'énergie: 2.
- Le nombre total d'électrons: 7; e formule: 1s 2 2s 2 2p 3.
Détails étudié les isotopes stables № élément 7, les nombres de masse – 14 et 15. Le contenu d'un des atomes de lumière qui est 99,64%. Les noyaux des isotopes radioactifs à vie courte est aussi 7 protons, et le nombre de neutrons est très variable: 4, 5, 6, 9, 10.
Azote dans la nature
Dans le cadre des molécules d'air sont présentes substance simple d'enveloppe de terre, dont la formule – N 2. Le contenu de l'azote gazeux dans l'atmosphère est d'environ 78,1% en volume. Composés inorganiques de l'élément chimique dans la croûte terrestre – divers sels d'ammonium et les nitrates (nitre). Les composés de la formule et les noms de certaines des substances les plus importantes:
- NH 3, de l' ammoniac.
- NO 2, le dioxyde d'azote.
- NaNO 3 nitrate de sodium.
- (NH 4) 2 SO 4, le sulfate d'ammonium.
La valence de l'atome d'azote dans ces deux derniers composés – IV. Du charbon, du sol, des organismes vivants contiennent également des atomes d'azote sous forme liée. L'azote est un composant d'amino-acides, des macromolécules d'ADN et des nucléotides d'ARN, des hormones et de l'hémoglobine. La teneur totale de l'élément chimique dans le corps humain atteint 2,5%.
substance simple
L'azote sous la forme de molécules diatomiques – le plus grand volume et le poids de l'air de l'atmosphère. Substance, dont la formule est N 2, n'a pas d' odeur, la couleur et le goût. Ce gaz est plus de 2/3 de la terre gaine d'air. L'azote liquide est une substance incolore, ressemblant à l'eau. Bout à une température de -195,8 ° C M (N 2) = 28 g / mol. peu de substance simple facilite l'oxygène, l'azote, l'air, sa densité est proche de 1.
Les atomes dans la molécule se lient fermement trois paires d'électrons partagées. Le composé présente une haute résistance aux produits chimiques, ce qui la distingue de l'oxygène et d'autres substances gazeuses. Pour une molécule d'azote est séparé en ses atomes constituants nécessaires à dépenser de l'énergie 942,9 kJ / mol. Le contact des trois paires d'électrons est très forte, commence à se décomposer quand il est chauffé au-dessus de 2000 ° C
ne pratiquement pas se produire dans des conditions normales, la dissociation des molécules en atomes. Inertie chimique est également causée par une absence totale d'azote de polarité dans sa molécule. Ils interagissent très faiblement avec l'autre, travaillant ainsi à l'état gazeux de la matière à pression normale et à une température voisine de la température ambiante. Une faible activité chimique de l'azote moléculaire est utilisé dans différents procédés et dispositifs où il est nécessaire de créer un environnement inerte.
La dissociation des molécules de N 2 peut se produire sous l'influence du rayonnement solaire dans la haute atmosphère. l'azote atomique est formé, qui réagit avec certains métaux et non-métaux, dans des conditions normales (phosphore, soufre, arsenic). Le résultat est la synthèse des substances étant des conditions du sol obtenues indirectement.

la valence de l'azote
L'enveloppe extérieure d'électrons de l'atome de former une électron 2 s 3 et p. Ces azote négatif peut donner des particules lors de l'interaction avec d'autres éléments qui correspondent à ses propriétés réductrices. Jouxtant l'octet manquant à 3 atomes d'électrons présente une capacité d'oxydation. Électronégativité de l'azote en dessous de ses propriétés métalliques sont moins prononcée que celle de fluor, d'oxygène et de chlore. Lors de l'interaction avec ces éléments chimiques azote donne des électrons (oxydent). Réduction à ions négatifs suivie d'une réaction avec d'autres métaux et non-métaux.
valence de l'azote typique – III. Dans ce cas, les liaisons chimiques sont formées par le p-attraction des électrons externe et la création de la paire commune (liaison). L' azote est capable de former liaison donneur-accepteur en raison de sa paire d'électrons, comme cela est le ion ammonium NH 4 +.
Obtenir dans le laboratoire et l'industrie
Une des méthodes de laboratoire basées sur les propriétés oxydantes de l' oxyde de cuivre. Utilisation composé d'azote avec de l' hydrogène – l' ammoniac NH 3. Cette vzaimoddeystvuet de gaz odeur désagréable de noir d'oxyde de cuivre en poudre. La réaction résultante produit de l'azote et apparaît cuivre métallique (poudre rouge). Déposée sur les parois du tube gouttes d'eau – un autre produit de réaction.
Une autre méthode de laboratoire qui utilise un composé d'azote avec les métaux – azide, par exemple NaN 3. Obtenu par un gaz qui n'a pas besoin d'être nettoyé des contaminants.
Le laboratoire est effectué décomposition du nitrite d'ammonium à l'azote et de l'eau. Pour démarrer la réaction, le chauffage est nécessaire, le processus se déroule avec dégagement de chaleur (exothermique). L'azote est contaminé par des impuretés, il est nettoyé et séché.
Préparation de l'azote dans l'industrie:
- la distillation fractionnée de l'air liquide – un procédé qui utilise les propriétés physiques de l'azote et de l'oxygène (différent du point d'ébullition);
- réaction chimique de l'air avec un charbon ardent;
- séparation de gaz par adsorption.
Interaction avec des métaux et de l'hydrogène – propriétés oxydantes
Inertie molécules durables ne permettent pas une synthèse directe de composés azotés. Pour activer les atomes nécessaires pour fort chauffage ou de la substance d'irradiation. L'azote peut réagir avec le lithium à la température ambiante, avec du magnésium, du calcium et du sodium, la réaction se déroule seulement par chauffage. nitrures métalliques correspondants sont formés.
L'interaction de l'azote avec de l'hydrogène a lieu à température élevée et de pression. En outre ce processus nécessite le catalyseur. L'ammoniac obtenu – un de la synthèse chimique le plus important. L'azote, comme agent oxydant, montre dans leurs états d'oxydation de tri négatif:
- 3 (ammoniac et d'autres composés azotés, l'hydrogène – nitrures);
- -2 (hydrazine N 2 H 4);
- -1 (hydroxylamine NH 2 OH).
Le nitrure le plus important – Ammoniac – préparé en grandes quantités dans l'industrie. Le gros problème depuis longtemps est resté l'inertie chimique de l'azote. Ses sources de matières premières ont été nitrate, mais les réserves minérales ont commencé à décliner rapidement avec la croissance de la production.

La grande réussite de la science chimique et la pratique a été la création de la technique de fixation de l'azote ammoniacal à l'échelle industrielle. Dans les colonnes spéciales est par synthèse directe – un processus réversible entre l'azote obtenu à partir de l'air et de l'hydrogène. Lors de la création des conditions optimales, déplace l'équilibre de cette réaction sur le côté du produit, en utilisant le rendement de l'ammoniac du catalyseur est de 97%.
Interaction avec l'oxygène – propriétés réductrices
Pour commencer la réaction de l'azote et de l'oxygène, doit être fort chauffage. Posséder une énergie suffisante à l' arc électrique et d' une décharge de foudre dans l'atmosphère. Les composés inorganiques les plus importantes dans lesquelles l'azote est dans son état d'oxydation positif:
- 1 (oxyde d'azote (I) N 2 O);
- 2 (NO de monoxyde d'azote);
- 3 (oxyde d'azote (III) N 2 O 3, HNO 2 de l' acide nitreux, les sels de nitrite de ceux – ci);
- 4 (dioxyde d'azote (IV) NO 2);
- 5 (pentoxyde d'azote (V) N 2 O 5, HNO 3 de l' acide nitrique, les nitrates).
La valeur de l'état naturel
Les plantes absorbent des ions ammonium et des anions nitrate dans le sol utilisé pour la synthèse des réactions chimiques de molécules organiques dans les cellules constamment en cours d'exécution. les bactéries des nodules d'azote atmosphériques peuvent assimiler – entités microscopiques formant des nodules sur les racines de légumineuses. En conséquence, ce groupe de plantes a reçu la batterie nécessaire, il enrichit le sol.
Au cours de tempêtes tropicales se produire la réaction d'oxydation de l'azote atmosphérique. Les oxydes sont dissous pour former des acides, ces composés d'azote pénètrent dans le sol dans l'eau. En raison du cycle des éléments de la nature sont constamment réapprovisionné ses réserves dans la croûte terrestre, l'air. des molécules organiques complexes contenant de l'azote dans sa composition, sont dégradés par les bactéries sur les composants inorganiques.
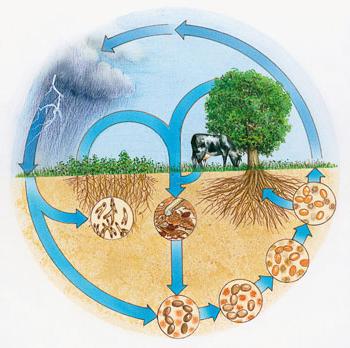
pratique
Les composés azotés les plus importants pour l'agriculture – un sel très soluble. Absorbé par les plantes urée nitrate (sodium, potassium, calcium), des composés d'ammonium (eau de l' ammoniac, le chlorure, le sulfate, le nitrate d'ammonium).
propriétés Inert plantes l'azote incapacité de l'absorber du plomb en dehors de la nécessité de prendre de fortes doses par an nitrates. Certaines parties de l'organisme végétal sont capables de stocker de l'énergie de macrocellule « pour l'avenir », ce qui dégrade la qualité du produit. L' excès de nitrates dans les légumes et les fruits peuvent provoquer une intoxication chez l' homme, la croissance des tumeurs malignes. Outre l'agriculture, les composés azotés sont utilisés dans d'autres industries:
- pour la préparation de médicaments;
- pour la synthèse chimique des composés de poids moléculaire élevé;
- dans la fabrication d'explosifs de trinitrotoluène (TNT);
- pour la production de colorants.
NO oxyde trouve une utilisation dans la chirurgie, la substance a un effet analgésique. La perte de sensation lorsque le gaz inhalé a remarqué que même les premiers chercheurs azote propriétés chimiques. Il y avait donc un nom commun « gaz hilarant ».
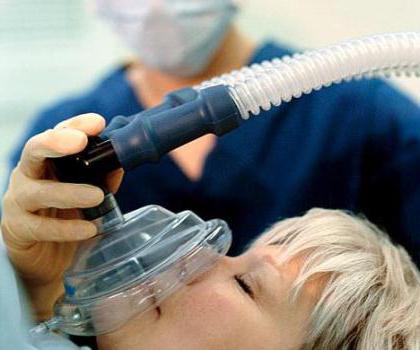
Le problème des nitrates dans les produits agricoles
Les sels de l' acide nitrique – Nitrate – contiennent un anion à charge simple NO 3. utilisé encore l'ancien nom du groupe de substances – nitrate d'ammonium. Nitrates sont utilisés pour fertiliser les champs, dans les serres, les jardins. Apportez-les au début du printemps avant la plantation, en été – sous la forme de tétées liquide. En eux-mêmes, la substance ne pose pas un grand danger pour les personnes, mais dans le corps, ils sont convertis en nitrites, puis en nitrosamines. Nitrite NO 2- ions – particules toxiques, ils provoquent l' oxydation du fer ferreux dans les molécules d'hémoglobine dans les ions trivalents. Dans cet état, la principale substance du sang humain et animal n'est pas en mesure de transporter l'oxygène et éliminer le dioxyde de carbone des tissus.
La contamination par les nitrates plus dangereux de la nourriture pour la santé humaine:
- les tumeurs malignes résultant de la conversion des nitrates en nitrosamines (cancérigène);
- le développement de la colite ulcéreuse,
- hypotension ou de l'hypertension;
- insuffisance cardiaque;
- troubles de la coagulation
- lésions du foie, le pancréas et le développement du diabète;
- le développement de l'insuffisance rénale;
- anémie, troubles de la mémoire, l'attention et l'intelligence.
L'utilisation simultanée de différents produits avec des doses importantes de nitrates conduit à une intoxication aiguë. Les sources peuvent être des plantes, l'eau potable, des plats de viande préparés. Trempant dans l'eau propre et la cuisson peut réduire la valeur nutritive des produits de nitrate. Les chercheurs ont constaté que des doses plus élevées de composés dangereux observés dans la production végétale et immature à effet de serre.

Le phosphore – élément pnictogène
Des atomes d'éléments chimiques qui sont dans la même colonne verticale du système périodique, présentent des propriétés communes. Le phosphore est situé dans la troisième période, on fait référence au groupe 15, ainsi que l'azote. Les éléments de structure des atomes similaires, mais il existe des différences dans les propriétés. L'azote et le phosphore présentent état de valence et d'oxydation négatif III en leurs composés avec des métaux et de l'hydrogène.
De nombreuses réactions de phosphore se déroulent à des températures ordinaires, d'un élément chimiquement actif. Est mis à réagir avec l' oxygène pour former P 2 O 5 oxyde supérieur. La solution aqueuse de ce matériau a les propriétés de l'acide (métaphosphorique). Tout en chauffant l'acide phosphorique est obtenu. Il définit une pluralité de types de sels, dont beaucoup sont les engrais minéraux, par exemple des superphosphates. composés d'azote et de phosphore forment une partie importante du cycle de la matière et de l'énergie sur notre planète, utilisé dans les domaines industriels, agricoles et autres.