La chaleur de formation – ce qui est-ce?
On parle de ce qui est la chaleur de formation, ainsi que de définir les conditions qui ont appelé standard. Pour régler ce problème, trouver les différences entre les substances simples et complexes. Pour consolider le concept de « chaleur de formation », considérer l'équation chimique spécifique.

L'enthalpie standard de formation de substances
76 kJ d'énergie libérée dans la réaction du carbone avec l'interaction de l'hydrogène gazeux. Dans ce cas, la figure – est l'effet thermique de la réaction chimique. Mais cette chaleur de formation de molécules de méthane à partir de substances simples. « Pourquoi? » – Vous demandez. Cela est dû au fait que les composants de départ sont du carbone et de l'hydrogène. 76 kJ / mol est l'énergie que les chimistes ont appelé « chaleur de formation ».
Fiches techniques
En thermochimie existe de nombreuses tables qui contiennent la chaleur de formation de diverses substances chimiques à partir de substances simples. Par exemple, la chaleur de formation de la substance, dont la formule CO 2 à l'état gazeux a une figure 393,5 kJ / mol.
importance pratique
Pourquoi les valeurs de données? La chaleur de formation – une valeur, qui est utilisée lors du calcul de l'effet thermique de tout procédé chimique. Afin de réaliser ces calculs nécessitent l'utilisation de la loi de la thermochimie.

thermochimie
Il est une loi fondamentale qui explique les processus énergétiques observés au cours de la réaction chimique. Au cours de l'interaction observé des changements qualitatifs dans le système de réaction. Certaines substances disparaissent, de nouveaux composants apparaissent à leur place. Ce processus est accompagné d'un changement dans l'énergie interne du système, il est représenté sous la forme de travail ou de la chaleur. Le travail, qui est associée à l'extension, pour les réactions chimiques est le chiffre le plus bas. La chaleur dégagée lors de la conversion d'un composant dans une autre substance peut être une grande valeur.
Si l'on considère une variété de transformations, presque tout ce qu'il ya absorption ou la libération d'une certaine quantité de chaleur. thermochimie – une section spéciale a été créée pour une explication des phénomènes.
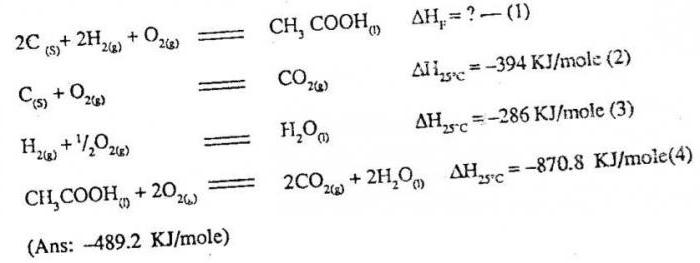
La loi de Hess
En raison de la première loi de la thermodynamique, il est devenu possible d'effectuer le calcul de l'effet thermique en fonction des conditions de la réaction chimique. Les calculs basés sur la principale loi de thermochimie, à savoir la loi de Hess. Laissez sa formulation: transformation chimique effet thermique lié à la nature, l'état initial et final de la matière, il est pas associé à la voie d'interaction.
Ce qui découle de cette formulation? Dans le cas d'un produit spécifique n'a pas besoin d'être appliquée qu'à un mode de réalisation de l'interaction, la réaction peut être effectuée de diverses manières. En tout état de cause, peu importe la façon dont vous donnez le matériau désiré, l'effet thermique du processus demeurera valeur inchangée. Pour définir, il est nécessaire de résumer les effets thermiques des transformations intermédiaires. En raison de la loi de Hess est devenu possible d'effectuer des calculs des quantités d'effets thermiques, il est impossible de réaliser dans le calorimètre. Par exemple, pour quantifier la chaleur de formation de substances de monoxyde de carbone calculées par la loi de Hess, mais par l'expérimentation de routine pour déterminer ce que vous ne réussirez pas. Il est donc important tables thermochimiques spéciales dans lesquelles les valeurs numériques inscrites pour diverses substances telles que définies dans des conditions normales
Les points importants dans le calcul
Étant donné que la chaleur de formation – est la chaleur de réaction, d' une importance particulière est l'état global de la substance en question. Par exemple, en prenant des mesures est considéré comme un état standard de graphite de carbone, au lieu de diamant. Veuillez également prendre en compte la pression et la température, à savoir les conditions dans lesquelles réagit d'abord des composants. Ces grandeurs physiques sont en mesure d'exercer une influence notable sur la réaction, est augmentée ou diminuée quantité d'énergie. Pour effectuer des calculs de base en thermochimie a décidé d'utiliser des indicateurs concrets de la pression et de la température.
conditions standard
Parce que la chaleur de formation de la matière – une détermination de l'effet de l'énergie est dans des conditions normales, de les distinguer. La température choisie pour le calcul de 298K (25 degrés centigrades) Pression – 1 atmosphère. En outre, un point important, qui mérite l'attention est le fait que la chaleur de formation pour toutes les substances simples est égal à zéro. Ce qui est logique, car les substances simples ne se forment pas, c'est, il n'y a pas de consommation d'énergie pour leur apparition.
éléments de thermochimie
Cette section de la chimie moderne a une signification particulière, car il est ici effectué des calculs importants sont les résultats utilisés pour la production d'énergie thermique. En thermochimie, il y a beaucoup de termes et de concepts qui sont importants pour fonctionner pour obtenir les résultats souhaités. L'enthalpie (? H) indique qu'une réaction chimique a eu lieu dans un système fermé, il n'y avait pas d'effet sur la réponse des autres corps réactionnels, la pression était constante. Cette précision vous permet de parler de l'exactitude des calculs effectués.
Selon le type de réaction est considérée, l'ampleur et le signe de l'effet thermique résultant peut varier considérablement. Ainsi, pour toutes les conversions impliquant la décomposition des substances complexes en plusieurs composants simples, on suppose l'absorption de chaleur. Connecter une pluralité de matériaux de départ de la réaction en un produit plus complexe accompagnée de la libération de quantités importantes d'énergie.

conclusion
Dans la résolution de tout problème thermochimique appliquer le même algorithme d'actions. Tout d'abord, dans le tableau est déterminé pour chaque composant de départ, ainsi que la quantité de produits de réaction de la chaleur de formation, en passant par l'état d'agrégat. Ensuite, la loi armée Hess équivaut à déterminer les quantités inconnues.
Une attention particulière doit être portée au compte des facteurs stéréochimiques existants avant que la substance initiale ou finale dans une équation particulière. Si la réaction est des substances simples, leur chaleur de formation standard est égale à zéro, à savoir, ces composants ont aucun effet sur le résultat obtenu par des calculs. Essayez d'utiliser les informations sur une réaction spécifique. Si l' on prend comme exemple le procédé de formation d'oxyde de fer (Fe 3+) de métal pur par réaction avec le graphite, la valeur de référence peut être trouvée chauffe standard de formation. Pour l' oxyde de fer (Fe 3+) , il sera -822,1 kJ / mol pour le graphite (substance simple) est zéro. La réaction résultante produit du monoxyde de carbone (CO), pour lequel l'indicateur a une valeur de – 110,5 kJ / mol, tandis que la chaleur de formation libérée fer correspond à zéro. L'enregistrement chauffe standard de formation de cette interaction chimique se caractérise comme suit:
A propos de 298 H = 3 × (-110,5) – (-822,1) = -331,5 + 822,1 = 490,6 kJ.
L'analyse obtenue par la loi Hess résultat numérique, il est possible de tirer une conclusion logique que le processus est une conversion endothermique, à savoir assume zatrachivaniya réaction de réduction du fer de l'énergie de son oxyde ferrique.