La concentration et la densité de l'acide sulfurique. La dépendance de la densité de la concentration en acide sulfurique dans la batterie de la voiture
Diluez et concentré acide sulfurique – il est si importants produits chimiques qu'ils produisent plus dans le monde que toute autre substance. La richesse économique du pays peut être évaluée en termes de produit acide sulfurique qui y sont.
Procédé de dissociation
L'acide sulfurique est utilisé sous la forme de solutions aqueuses de diverses concentrations. Elle subit une réaction de dissociation en deux étapes, en produisant des ions H + sont en solution.
H 2 SO 4 = H + + HSO 4 -;
HSO 4 – = H + + SO 4 -2.
L' acide sulfurique est un solide, et la première étape de dissociation se produit si rapidement que la quasi – totalité de la molécule d' origine se décomposent en ions H + et HSO 4 -1 -ions (sulfate d'hydrogène) en solution. Récente se désintègrent en partie en outre, en libérant des ions H + et l' autre en laissant un ion sulfate (SO 4 -2) en solution. Cependant, l' hydrogénosulfate, étant un acide faible, prévaut toujours dans une solution de H + et SO 4 -2. dissociation complète , il se produit uniquement lorsque la densité de la solution d'acide sulfurique est proche de la densité de l' eau, r. F sous haute dilution. 
Propriétés de l'acide sulfurique
Il est particulière dans le sens où il peut agir comme un acide classique ou un oxydant fort – en fonction de la température et de la concentration. Une solution diluée froide d'acide sulfurique réagit avec le métal actif pour donner le sel (sulfate) et l'évolution de l'hydrogène gazeux. Par exemple, la réaction entre dilué froid H 2 SO 4 ( en supposant que sa dissociation étape pleine) et du zinc métallique comme suit:
Zn + H 2 SO 4 = ZnSO 4 + H 2.
L'acide sulfurique concentré chaud, dont la densité est d' environ 1,8 g / cm 3, peut agir comme un oxydant, la réaction avec des matériaux qui sont généralement inerte aux acides, tels que par exemple le cuivre métallique. Pendant la réaction, le cuivre est oxydé, et la masse acide est réduite, une solution est formée de sulfate de cuivre (II) dans de l' eau et du dioxyde de soufre gazeux (SO 2) au lieu de l' hydrogène, ce qui serait attendu en faisant réagir l'acide avec un métal.
Cu + 2 H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O. 
Comme généralement exprimé par la concentration des solutions
En fait, la concentration d'une solution peut être exprimée de différentes manières, mais la concentration la plus largement utilisée en poids. Il indique le nombre de grammes de soluté dans un certain poids ou en volume de la solution ou du solvant (typiquement 1000 g, 1000 cm 3, 100 cm 3 et 1 dm 3). Au lieu de la masse en grammes d'une substance peut prendre la quantité, exprimée en moles, – puis l'obtention de la concentration molaire de 1000 g ou une solution dm 3.
Si la concentration molaire déterminée par rapport à la quantité non de la solution, mais seulement au solvant, on l'appelle la molalité de la solution. Elle est caractérisée par l'indépendance de la température.
Souvent, la concentration pondérale indiquée en grammes par 100 grammes de solvant. En multipliant ce nombre par 100%, il est préparé un pour cent en poids (par concentration). C'est, cette méthode est le plus souvent utilisé comme appliqué à une solution d'acide sulfurique.
Chaque valeur de la concentration en solution, déterminée à une température donnée, il correspond à une densité très spécifique (par exemple, la densité de la solution d'acide sulfurique). Par conséquent, il est parfois solution caractérisée. Par exemple, H 2 SO 4, la concentration en pourcentage caractérisé 95,72%, une masse volumique de 1,835 g / cm 3 à t = 20 ° C Comment déterminer la concentration d'une telle solution, si on leur donne que la densité de l'acide sulfurique? Le tableau donne une telle correspondance est une partie intégrante de tous les manuels de chimie analytique ou générale.
EXEMPLE recalcul de concentration
Laissez-passer d'un mode d'expression à une autre concentration de la solution. Supposons que nous ayons H 2 SO 4 dans de l'eau avec une concentration de 60% d'intérêt. Nous définissons tout d'abord la densité de l'acide sulfurique correspondant. Le tableau contenant les pourcentages (première colonne) et la densité correspondante de la solution aqueuse de H 2 SO 4 (quatrième colonne), est représenté ci – dessous. 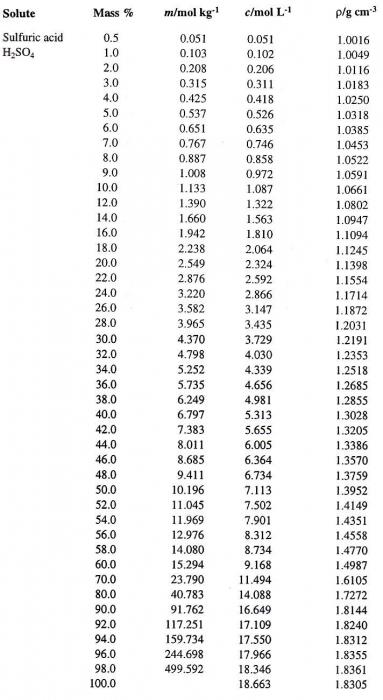
Il détermine la valeur de consigne qui est égale à 1,4987 g / cm 3. On calcule maintenant la molarité de la solution. Pour cela , il est nécessaire de déterminer la masse de H 2 SO 4 dans 1 litre de solution et le nombre correspondant de moles d'acide.
Volume, qui occupent 100 g de solution de stock:
100 / 1,4987 = 66,7 ml.
Etant donné que dans 66,7 ml de solution à 60% contenaient 60 g de l'acide dans 1 litre d'contiendra:
(60 / 66,7) x 1000 = 899, 55 g.
poids molaire acide sulfurique égale à 98. Par conséquent, le nombre de moles contenues dans 899,55 g de ses grammes, sera:
899,55 / 98 = 9,18 mol.
La dépendance de la densité de la concentration en acide sulfurique est représenté sur la Fig. ci-dessous. 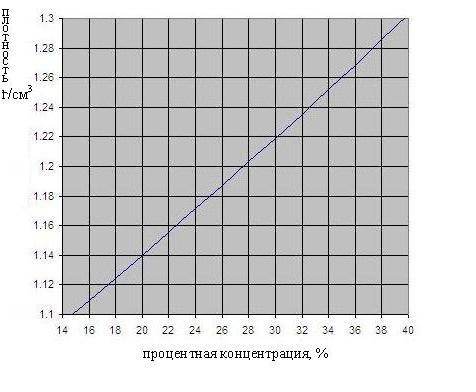
L'utilisation d'acide sulfurique
Il est utilisé dans diverses industries. Dans la production de fer et d'acier est utilisé pour le nettoyage de la surface métallique avant qu'elle ne soit recouverte d'une autre substance impliquée dans la création de colorants synthétiques, ainsi que d'autres types d'acides tels que l'acide chlorhydrique et nitrique. Il est également utilisé dans la fabrication de produits pharmaceutiques, d'engrais et d'explosifs, et est encore un réactif important pour éliminer les impuretés du pétrole brut dans l'industrie du raffinage.
Ce produit chimique est extrêmement utile dans la vie quotidienne, et est facilement disponible en tant que solution d'acide sulfurique utilisé dans les batteries plomb-acide (par exemple, ceux qui sont dans les automobiles). Cet acide a généralement une concentration d'environ 30% à 35% de H 2 SO 4 en poids, l'équilibre – l' eau.
Pour de nombreuses applications grand public 30% H 2 SO 4 sera plus que suffisant pour répondre à leurs besoins. Cependant, dans l'industrie et il exige une concentration beaucoup plus élevée d'acide sulfurique. En règle générale, lors de la fabrication, il est tout d'abord obtenu suffisamment diluée et contaminée par des inclusions organiques. On obtient l'acide concentré en deux étapes: tout d'abord, il a été ajusté à 70%, puis – dans une deuxième étape – est portée à 96-98%, ce qui est le paramètre limitant de la production économiquement viable.
La densité de l'acide sulfurique et ses variétés
Bien que presque 99% d' acide sulfurique peut être brièvement au reflux, mais la perte subséquente de SO 3 au niveau du point d'ébullition diminue la concentration de 98,3%. En général, les espèces dont l'indice de 98% plus stables au stockage.
Les acides de qualité commerciale varier la concentration d'intérêt, et pour lequel il est sélectionné ces valeurs au cours de laquelle la température de cristallisation faible. Ceci est fait pour réduire la perte de cristaux d'acide sulfurique précipiter pendant le transport et le stockage. Les variétés principales sont:
- La tour ( d' azote) – 75%. la densité de l' acide sulfurique de la classe est égale à 1670 kg / m 3. Obtenez son soi-disant. Procédé d' azote , dans lequel le nitroso résultant traitée (ce qui est aussi H 2 SO 4, mais avec des oxydes d'azote dissous) dans le primaire à cuire le gaz brut calciné contenant du dioxyde de soufre SO 2, dans les tours alignées ( d' où les variétés de nom). Par conséquent alloué oxydes d'acides et d'azote qui ne sont pas consommés dans le processus, et est retourné vers le cycle de production.
- Contact – 92,5-98,0%. la densité de l' acide sulfurique de 98% de la classe est égale à 1836.5 kg / m 3. Il a également obtenu à partir de gaz de grillage contenant du SO 2, dans lequel le procédé comprend l' oxydation du dioxyde anhydride de SO 3 avec son contact ( d' où le nom de grade) avec plusieurs couches de catalyseur au vanadium solide.
- Oleum – 104,5%. Sa densité est égale à 1896,8 kg / m 3. Cette solution de SO 3 dans H 2 SO 4, dans lequel le premier composant contient de 20%, et de l' acide – est de 104,5%.
- De haute qualité oleum – 114,6%. Sa densité – 2002 kg / m 3.
- Batterie – 92-94%.
Comment la batterie de voiture
Le fonctionnement de celui-ci des dispositifs électriques les plus populaires est entièrement basé sur les procédés électrochimiques qui se produisent en présence d'acide sulfurique aqueux.
Automobile batterie contient diluer l'électrolyte d'acide sulfurique, et des électrodes positives et négatives sous la forme de plusieurs plaques. plaques positives sont constituées d'un matériau brun rougeâtre – de dioxyde de plomb (PbO 2), et négatif – de plomb gris « éponge » (Pb).
Etant donné que les électrodes sont en plomb ou d'un matériau contenant du plomb, ce type de batterie est souvent appelée batterie plomb-acide. Son fonctionnement, t. E. La tension de sortie est déterminée directement par ce qui est à ce moment la masse volumique de l' acide sulfurique (kg / m3 ou g / cm 3), rempli de la batterie comme électrolyte.
Qu'est-ce qui se passe avec l'électrolyte lorsque la batterie se décharge,
L'électrolyte batterie au plomb-acide est une solution rechargeable d'acide sulfurique dans de l' eau distillée chimiquement pur à une concentration d'intérêt de 30% à pleine charge. Net acide a une masse volumique de 1,835 g / cm 3, de l' électrolyte – environ 1,300 g / cm 3. Lorsque la batterie est déchargée, des réactions électrochimiques se produisent résultant dans l'acide sulfurique retiré de l'électrolyte. concentration de la solution dépend presque proportionnelle à la densité, de sorte qu'il devrait diminuer en raison de la diminution de la concentration d'électrolyte.
Tant que le courant de décharge circule à travers l'acide de la batterie est largement utilisé à proximité de ses électrodes et l'électrolyte devient plus dilué. diffusion de l'acide à partir du volume total de l'électrolyte et les plaques d'électrode supporte une intensité sensiblement constante de réactions chimiques et, par conséquent, la tension de sortie.
Au début du processus de décharge de la diffusion de l'électrolyte acide dans la plaque se produit rapidement, car le sulfate résultant avec des pores encore marqués dans le matériau actif des électrodes. Lorsque le sulfate commence à se former et remplir les pores des électrodes, la diffusion se fait plus lentement.
Théoriquement, il est possible de continuer à exercer aussi longtemps que tout l'acide ne sera pas utilisé, et l'électrolyte sera composé d'eau pure. Cependant, l' expérience montre que le niveau ne doit pas se poursuivre après la densité de l' électrolyte est tombé à 1,150 g / cm3.
Lorsque la densité décroît de 1300 à 1150, ce qui signifie qu'une bonne partie du sulfate a été formé pendant la réaction, et il remplit tous les pores dans la matière active sur les plaques, à savoir. E. De la solution déjà choisi la quasi-totalité de l'acide sulfurique. La densité dépend de la concentration proportionnellement et, de même, la densité de la charge de la batterie dépend. Fig. ci-dessous montre la dépendance de la densité de l'électrolyte de la batterie. 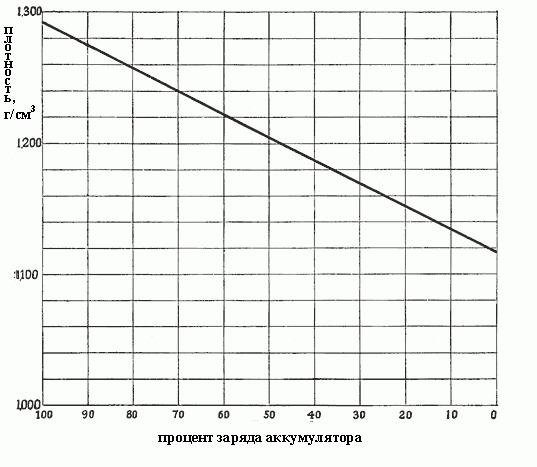
Modification de la densité de l'électrolyte, le meilleur moyen de détermination d'état de décharge de la batterie, à condition que ce dernier ne soit utilisé.
Degrés décharge de la batterie de la voiture en fonction de la densité de l'électrolyte
Sa densité doit être mesurée toutes les deux semaines et doit toujours être la lecture de l'enregistrement pour une utilisation future.
L'électrolyte plus dense, plus il contient plus d'acide et plus la batterie est chargée. Densité 1,300-1,280 g / cm 3 indique une charge complète. En règle générale, suivant le degré de décharge de la batterie variable en fonction de la densité de l'électrolyte:
- 1,300-1,280 – complètement chargée:
- 1,280-1,200 – plus de la moitié vide;
- 1,200-1,150 – charge moins de la moitié;
- 1,150 – presque vide.
Dans une batterie complètement chargée avant de connecter la tension d'alimentation de l'automobile de chaque cellule est 2,5 à 2,7 V. Dès que la charge est connectée, la tension chute rapidement à environ 2,1 V pendant trois ou quatre minutes. Ceci est dû à la formation d'une mince couche de sulfate de plomb sur la surface des plaques d'électrode négative et entre la couche de plomb et les plaques de peroxyde de métal positifs. La valeur finale de la tension de la cellule après un réseau routier reliant environ 2,15-2,18 volts.
Lorsque le courant commence à circuler à travers la batterie pendant la première heure de fonctionnement, il y a une chute de tension de 2 V en raison de la résistance accrue de la cellule interne due à la formation de plus grandes quantités de sulfate qui remplit les pores des plaques et la sélection de l'acide de l'électrolyte. Peu de temps avant le début de l'écoulement de la densité de courant de l'électrolyte est maximale et égale à 1,300 g / cm 3. Initialement, il se produit rapidement une dépression, puis régler l'état d'équilibre entre la densité de l'acide à proximité des plaques et des électrodes de sélection de volume sensiblement électrolyte supporté acide entrant nouvel acide pièces de la masse de l'électrolyte. La densité moyenne de l'électrolyte continue à diminuer régulièrement sur la relation représentée sur la Fig. ci-dessus. Après une chute de tension initiale diminue plus lentement, son taux de réduction dépend de la charge de la batterie. Temps de traitement de décharge d'horaire est représenté sur la Fig. ci-dessous. 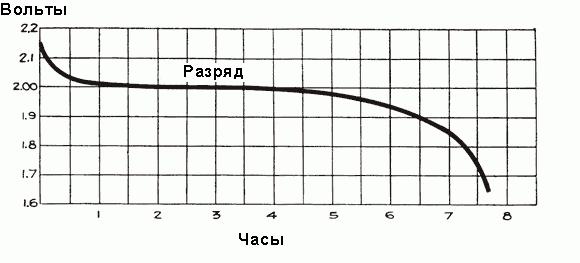
Le contrôle de l'état de l'électrolyte dans la batterie
Pour déterminer le densimètre de densité utilisée. Il est composé d'un tube de verre scellé avec une extension à l'extrémité inférieure, remplie de mercure ou de la grenaille, et une échelle graduée sur l'extrémité supérieure. Cette échelle marquée de 1100 à 1300 avec différentes valeurs intermédiaires, comme représenté sur la Fig. ci-dessous. Si le densimètre est placé dans un électrolyte, il coulera jusqu'à une certaine profondeur. Ainsi, il va déplacer un certain volume d'électrolyte, et lorsque la position d'équilibre est atteint, le poids du volume déplacé sera juste égale à la densimètre de poids. Etant donné que la densité de l'électrolyte est égal au rapport de son poids à volume et le poids du densimètre est connu, chaque niveau d'immersion dans la solution correspond à une densité particulière de son. 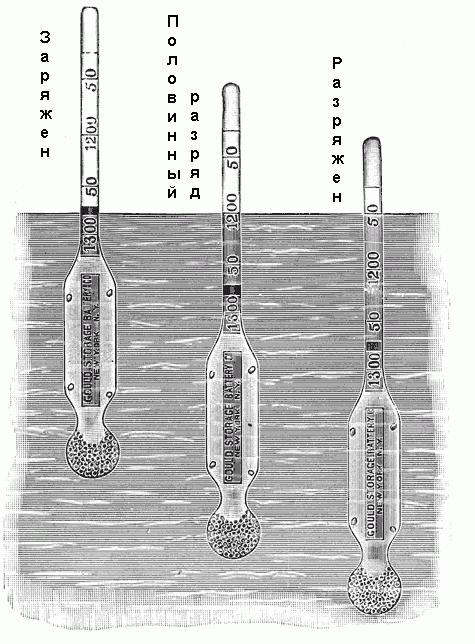 Certains ont aréomètres avec les valeurs de l'échelle de densité, mais sont marquées par « accusé », « la moitié d'un chiffre », « la pleine décharge » ou similaires.
Certains ont aréomètres avec les valeurs de l'échelle de densité, mais sont marquées par « accusé », « la moitié d'un chiffre », « la pleine décharge » ou similaires.