L'ammoniac – est l'antipode et analogique … l'eau?
L'odeur de gaz est connu pour tout le monde – vous pouvez vous sentir immédiatement lorsque vous ouvrez un pot avec de l'ammoniaque. Quelque chose au sujet de ses propriétés, on nous a dit à l'école. En outre, il est connu, cependant, qu'il est l'un des principaux produits de l'industrie chimique: à savoir qu'il est plus facile de transformer l'azote, qui n'aime pas entrer dans des réactions chimiques. L' ammoniac – c'est le premier point de départ pour commencer la production de nombreux composés azotés: divers nitrites et nitrates, des explosifs et des colorants d'aniline, les produits pharmaceutiques et des plastiques …
fond
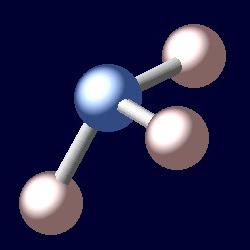 Le nom de la substance dérivée du grec «Hals», qui se traduit par l'ammoniac. molécule d'ammoniac est une certaine similitude pyramide, dont le sommet est un atome d'azote et en bas – trois atomes d'hydrogène. La formule de ce composé – NH3. Dans des conditions normales, l'ammoniac – est un gaz incolore à odeur piquante de étouffante. Sa densité à -33,35 ° C (température d' ébullition) égale à 0,681 g / cm 3. Une substance est fondue à -77,7 ° C Masse molaire de l'ammoniac est de 17 grammes par mole. La pression de 0,9 MPa à la température ambiante, amène l'ammoniac à se rétrécir. Recevoir dans l'industrie sous pression par l' intermédiaire d'une synthèse catalytique de l' hydrogène et de l' oxygène. Liquide ammoniac – un réfrigérant d'engrais hautement concentré. Avec ce matériel doit être prudent, car il est toxique et explosif.
Le nom de la substance dérivée du grec «Hals», qui se traduit par l'ammoniac. molécule d'ammoniac est une certaine similitude pyramide, dont le sommet est un atome d'azote et en bas – trois atomes d'hydrogène. La formule de ce composé – NH3. Dans des conditions normales, l'ammoniac – est un gaz incolore à odeur piquante de étouffante. Sa densité à -33,35 ° C (température d' ébullition) égale à 0,681 g / cm 3. Une substance est fondue à -77,7 ° C Masse molaire de l'ammoniac est de 17 grammes par mole. La pression de 0,9 MPa à la température ambiante, amène l'ammoniac à se rétrécir. Recevoir dans l'industrie sous pression par l' intermédiaire d'une synthèse catalytique de l' hydrogène et de l' oxygène. Liquide ammoniac – un réfrigérant d'engrais hautement concentré. Avec ce matériel doit être prudent, car il est toxique et explosif.
faits intéressants
L'ammoniaque liquide a des propriétés plutôt inhabituelles. Extérieurement, il ressemble à l'eau claire. Comme H 2 O, on dissout parfaitement de nombreux organiques et des composés inorganiques. La plupart des sels se dissocient en ions dans celui-ci lorsqu'il est dissous. En même temps, la réaction chimique, contrairement à l'eau, il se produit tout à fait différemment.
|
ZnCl2 |
BaCl 2 |
KCI |
NaCl |
KI |
Ba (NO3) 2 |
Agi |
||
|
Solubilité à 20 ° C pour 100 g de solvant |
ammoniaque |
0 |
0 |
0,04 |
3 |
182 |
97 |
207 |
|
eau |
367 |
36 |
34 |
36 |
144 |
9 |
0 |
|
Les données dans ce tableau conduit à l'idée que l'ammoniac liquide – un environnement unique pour certaines réactions de change qui ne sont pas réalisables dans des solutions aqueuses.  Par exemple:
Par exemple:
2AgCl + Ba (NO 3) 2 = 2AgNO 3 + BaCl 2.
Parce que NH 3 est accepteur forte de protons, l' acide acétique, en dépit du fait qu'il est considéré comme faible, entièrement prodissotsiiruet, tout comme le font l' acide fort. Les plus intéressantes sont des solutions dans l' ammoniac liquide métaux alcalins. En 1864, les chimistes ont remarqué que si vous leur donnez un peu de temps, l'ammoniac s'évapore, et dans les sédiments seraient un métal pur. Il en va de même chose est vraie avec des solutions aqueuses de sels. La différence est que les métaux alcalins, même en petites quantités, mais néanmoins mis à réagir avec de l'ammoniac, de manière à former des amides de type sel:
2Na + 2NH 3 = 2NaNH 2 + H 2.
Ces derniers sont des substances très stables, mais en contact avec l'eau affaisse immédiatement:
NaNH2 + H 2 O = NH 3 + NaOH.
 Dans l'étude des propriétés des chimistes de l'ammoniac liquide ont remarqué que, lorsque le métal dissous dans celui-ci, le volume de la solution augmente. De plus, alors que sa densité diminue. Ceci est une autre différence considérée comme solvant par l'eau ordinaire. Il est difficile à croire, mais la concentration et la solution diluée d'un métal alcalin dans l'ammoniac liquide ne sont pas mélangés les uns avec les autres, en dépit du fait que le métal dans les deux la même chose! Merci à des expériences constamment trouvé de nouveaux faits surprenants. Ainsi, il a été constaté que dans un liquide congelé une solution d'ammoniaque de sodium est très faible résistance, et par conséquent, NH 3 peut être utilisé pour produire le système supraconducteur. Sans surprise, ce gaz et ses solutions sont toujours intéressés à l'esprit des deux physiciens et des chimistes.
Dans l'étude des propriétés des chimistes de l'ammoniac liquide ont remarqué que, lorsque le métal dissous dans celui-ci, le volume de la solution augmente. De plus, alors que sa densité diminue. Ceci est une autre différence considérée comme solvant par l'eau ordinaire. Il est difficile à croire, mais la concentration et la solution diluée d'un métal alcalin dans l'ammoniac liquide ne sont pas mélangés les uns avec les autres, en dépit du fait que le métal dans les deux la même chose! Merci à des expériences constamment trouvé de nouveaux faits surprenants. Ainsi, il a été constaté que dans un liquide congelé une solution d'ammoniaque de sodium est très faible résistance, et par conséquent, NH 3 peut être utilisé pour produire le système supraconducteur. Sans surprise, ce gaz et ses solutions sont toujours intéressés à l'esprit des deux physiciens et des chimistes.