Aujourd'hui, nous allons essayer de trouver une réponse à la question « Heat – que ..? ». Dans cet article, nous considérons que est un processus, que ses espèces existent dans la nature, et de savoir quelle est la relation entre le transfert de chaleur et de la thermodynamique.
définition

Transfert de chaleur – un processus physique, dont l'essence est de transférer l' énergie thermique. Échange a lieu entre les deux corps, ou leur système. Ainsi, le transfert de chaleur préalable sera par un corps chauffé à une moins chauffée.
Caractéristiques du processus
Le transfert de chaleur – c'est le genre de phénomène qui peut se produire par contact direct, et en présence de parois de séparation. Dans le premier cas, tout clair, mais dans le second corps à utiliser comme matériaux barrières, de l'environnement. Le transfert de chaleur se produira dans les cas où le système composé de deux corps ou plus, ne sont pas dans un état d'équilibre thermique. À savoir, l'un des objets a une température supérieure ou inférieure à l'autre. Ici transfère alors la puissance thermique. Il est logique de supposer qu'il sera achevé lorsque le système est dans un état d'équilibre thermodynamique ou thermique. Le processus se produit spontanément, comme on peut dire la deuxième loi de la thermodynamique.
types
Le transfert de chaleur – un processus qui peut être divisé en trois méthodes. Ils ont un caractère de base, car en eux il y a un vrai sous avec ses propres caractéristiques sur un pied d'égalité avec les lois générales. Aujourd'hui , est divisé en trois types de transfert de chaleur. Cette conduction, la convection et le rayonnement. Commençons par le premier, peut-être.
Méthodes de transfert de chaleur. conductivité thermique.

Donc, est la propriété d'un corps matériel pour effectuer le transfert d'énergie. Ainsi, il est transféré des plus chaudes parties du même plus froide. La base de ce phénomène est le principe du mouvement chaotique de molécules. Ce mouvement soi-disant brownien. Plus la température du corps, plus elle se déplace dans la molécule, parce qu'ils ont une plus grande énergie cinétique. Le procédé implique des électrons de conduction thermique, des molécules, des atomes. Elle est réalisée dans le corps, les différentes parties ayant des températures inégales.
Si la substance est capable de conduire la chaleur, on peut parler d'une caractéristique quantitative. Dans ce cas, il joue le rôle de la conductivité thermique. Cette caractéristique indique la quantité de chaleur passe à travers les différents paramètres de longueur et de superficie par unité de temps. Dans ce cas, la température du corps va changer exactement 1 K.
Auparavant, on croyait que l'échange de chaleur dans des corps différents (y compris les structures de trame de transmission de chaleur) en raison du fait que d'une partie du corps à une autre que l'on appelle des flux caloriques. Cependant, des signes de son existence réelle, personne n'a trouvé, et quand la théorie moléculaire cinétique a développé un certain niveau, tout au sujet du calorique et oublié de penser, parce que l'hypothèse était intenable.
Convection. L'eau de transfert de chaleur

De cette manière l'échange d'énergie thermique compris le transfert avec des fils internes. Imaginons une bouilloire d'eau. Comme on le sait, un flux d'air chaud montée vers le haut. Un froid, plus lourd tomber vers le bas. Alors pourquoi toute l'eau devrait-il en être autrement? Elle est exactement la même chose. Et au cours de ce cycle, toutes les couches d'eau, peu importe combien ils peuvent être, chauffent avant l'état d'équilibre thermique. Dans certaines conditions, bien sûr.
radiation
Ce procédé est le principe d'un rayonnement électromagnétique. Elle est due à l'énergie interne. aller fortement dans la théorie du rayonnement thermique ne commence, notez simplement que la raison en est ici le dispositif de particules chargées, des atomes et des molécules.
Des tâches simples sur la conductivité thermique
Maintenant, nous allons parler de la façon dont, dans la pratique ressemble à des calculs de transfert de chaleur. Réglons un simple problème lié à la quantité de chaleur. Supposons que nous avons une masse d'eau égale à un demi-kilo. La température de l'eau à partir – 0 degrés Celsius, finale – 100. Nous trouvons quantité de chaleur a passé masse de contact pour chauffer la substance.
Pour ce faire , nous avons besoin de formule Q = cm (t 2 -t 1), dans laquelle Q – quantité de chaleur, c – la propre chaleur de l' eau, m – masse de matière, t 1 – initial, t 2 – température finale. La nappe phréatique est la valeur du caractère c. Capacité thermique spécifique est égale à 4200 J / kg * C. Maintenant, nous substituons ces valeurs dans la formule. Nous constatons que la quantité de chaleur est égale à 210 000 J, ou 210 kJ.
La première loi de la thermodynamique

La thermodynamique et le transfert de chaleur sont liés par certaines lois. Dans leur base – la connaissance que le changement de l'énergie interne dans le système peut être réalisé par deux méthodes. Origine – opération de marquage mécanique. Le second – un message d'une certaine quantité de chaleur. Sur la base de ce principe, par ailleurs, la première loi de la thermodynamique. Voici le libellé: Si le système a été rapporté certaine quantité de chaleur, il sera consacré à des travaux de commission sur les organismes externes ou à incrémenter son énergie interne. L'expression mathématique est: QD = dU + dA.
Plus ou moins?
Absolument toutes les valeurs qui font partie de l'enregistrement mathématique de la première loi de la thermodynamique peut être écrit comme avec le « plus » et avec un signe « moins ». Le choix du processus sera dicté par les conditions. Supposons que le système reçoit une certaine quantité de chaleur. Dans ce cas, le corps dans sa chaleur. Par conséquent, il y a une expansion de gaz et, par conséquent, le travail est fait. En conséquence, la valeur sera positive. Si la quantité de chaleur enlevé, le gaz est refroidi, le travail se fait sur elle. Les valeurs seront les valeurs inverses.
Une formulation alternative de la première loi de la thermodynamique
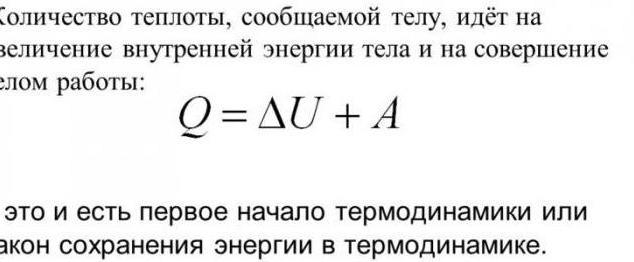
Supposons que nous avons un moteur de traitement par lots. Ce fluide de travail (ou système), effectuer un processus cyclique. Il est appelé un cycle. En conséquence, le système retourne à son état d'origine. Il serait logique de supposer que, dans ce cas, la variation de l'énergie interne est égale à zéro. Il se trouve que la quantité de chaleur sera égal au travail parfait. Ces dispositions permettent de formuler la première loi de la thermodynamique est déjà différent.
De cela, nous pouvons comprendre que dans la nature ne peut pas être une machine à mouvement perpétuel du premier type. Autrement dit, un dispositif qui exécute un travail en une quantité plus importante par rapport à l'énergie reçue de l'extérieur. Dans ce cas, l'action doit être effectuée périodiquement.
La première loi de la thermodynamique pour izoprotsessov
Prenons, pour commencer processus isochore. Sous lui, le volume reste constant. Ainsi, le changement de volume sera égal à zéro. Par conséquent, le travail sera également nul. Nous retirons cette composante de la première loi de la thermodynamique, et obtient alors la formule dQ = dU. Par conséquent, pour le procédé isochore toute la chaleur placé dans un système, va en augmentant l'énergie interne du gaz ou des mélanges de ceux-ci.
Maintenant, nous allons parler d'un processus isobarique. Demeure dans celle-ci une pression constante. Dans ce cas, l'énergie va changer dans les travaux de commission parallèle. Voici la formule originale: QD = dU + pdV. Nous pouvons facilement calculer effectuer des travaux. Il sera égal à l'expression uR (T 2 -T 1). Soit dit en passant, c'est le sens physique de la constante de gaz universelle. En présence d'une mole de gaz et la différence de température, un composant Kelvin, la constante universelle des gaz est égale au travail effectué au cours d'un processus isobare.









