Parlons de la façon de déterminer le type d'hybridation, ainsi que considérer la structure géométrique de la molécule.
L'histoire du terme
Au début du XXe siècle, L. Polinglom a proposé une théorie de la géométrie des molécules avec une liaison covalente. Comme base était pris pour former une connexion de chevauchement de nuages d'électrons. La méthode est devenu connu sous le nom des liaisons de valence. Comment déterminer le type d'hybridation des atomes dans les composés? Auteur de la théorie proposée de prendre en compte le mélange des hybrides orbitales.
définition
Afin de comprendre comment déterminer le type d'hybridation dans les composés, nous expliquons que ce terme fait référence.
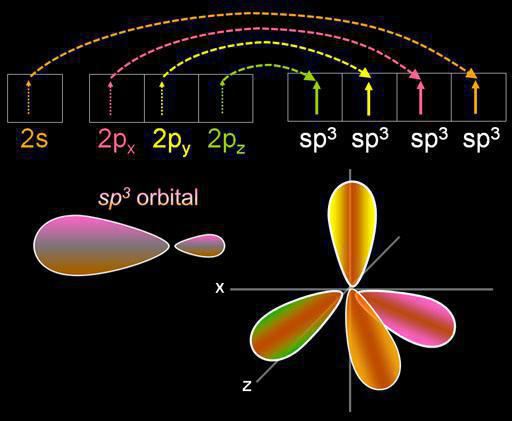
L'hybridation est le mélange des orbitales électroniques. Ce processus est accompagné par la distribution d'énergie en eux, changer leur forme. Selon la quantité seront mélangés et s- p orbitaux, le type d'hybridation peut varier. Les composés organiques du carbone peut exister dans un état sp, sp2, sp3. Il y a aussi des formes plus complexes impliquant, en plus sp, d orbitaux.
Règles pour identifier des molécules inorganiques
L'hybridation peut révéler mode de réalisation pour des composés ayant une liaison chimique covalente avec le type AWP. A – atome basique, B – ligand, n – nombre de deux ou plus. Dans une situation similaire dans l'hybridation entrerai de valence les orbitales de l'atome principal.
Méthodes de détermination
Nous allons parler plus sur la façon de déterminer le type d'hybridation. Dans la compréhension chimique du terme implique des formes de changement d'énergie et orbitals. Il existe un processus similaire dans les cas où les électrons sont utilisés qui appartiennent à différents types de formation d'une liaison.
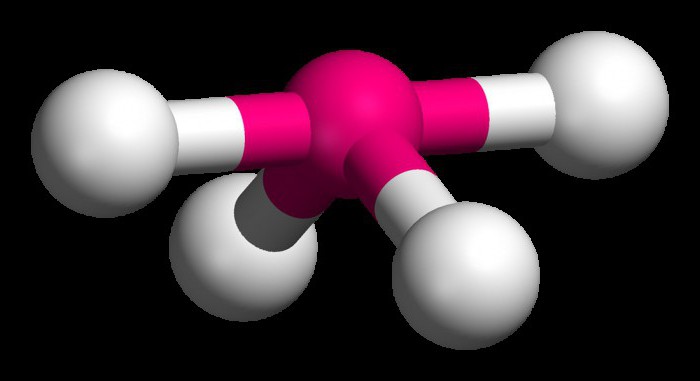
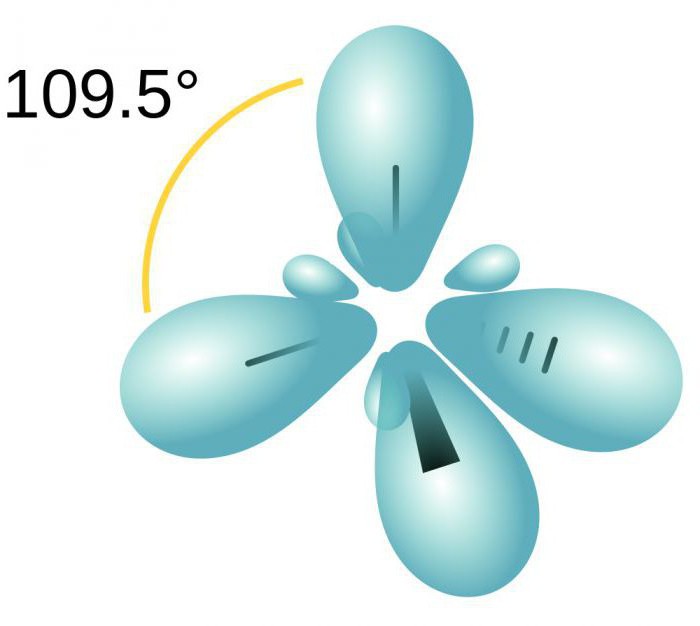
Pour comprendre comment déterminer le type d'hybridation, considérons la molécule de méthane. Ce matériau est le premier membre de la série homologue d'hydrocarbures saturés (limite). Dans l'espace de la molécule CH4 est tétraèdre. atome de carbone unique forme une liaison hydrogène d'énergie similaire et de la longueur. Afin de former un tel nuage hybride, il y a trois p es et un électron.
Quatre nuages sont mélangés, et il existe quatre types identiques (hybrides) ayant une forme irrégulière huit. Nous appelons ce type d'hybridation sp3. Tous les hydrocarbures dans la composition qui ne simple liaison (simple), il est caractérisé par ce type d'hybridation de l'atome de carbone. angle de Bond est de 109 degrés 28 minutes.
Nous continuons à parler de la façon de déterminer le type d'hybridation. Des exemples de l' hydrocarbure insaturé de la série éthylénique donnent une idée de sp2-hybridation. Par exemple, dans une molécule d'éthylène des quatre électrons de valence dans la formation de liaisons chimiques est utilisé seulement trois. Le reste p-électron non hybride entre dans la formation d'une double liaison.
Acétylène est le plus simple représentant de la classe SpN2p-2. La particularité de cette classe d'hydrocarbures est la présence d'une triple liaison. Sur les quatre électrons de valence de l'atome de carbone seulement deux changer de forme et de l'énergie, devenant hybride. Les deux électrons restants participant à la formation de deux doubles liaisons, la détermination de la nature insaturée de cette classe de composés organiques.
conclusion
Compte tenu de la question concernant la liaison chimique covalente de substances organiques et inorganiques, envisager l'hybridation d'orbitales atomiques. Dans ce cas, il y a un alignement de leur énergie et de la forme. Electronic, situé à proximité du noyau de l'atome lié, caractérisé par un ensemble d'orbitales identiques qui possèdent des nombres quantiques. Informations sur le type d'hybridation permet d'évaluer les propriétés chimiques de la substance.








