Cétones: propriétés chimiques et définition
La chimie organique est une science très compliquée, mais intéressante. Après tout, les composés des mêmes éléments, en différents nombres et séquences, contribuent à la formation de substances de différentes propriétés. Considérons les composés du groupe carbonyle appelés «cétones» (propriétés chimiques, caractéristiques physiques, méthodes de leur synthèse). Et comparez-les avec d'autres substances du même genre – aldéhydes.
Des cétones
Ce mot est un nom commun pour toute une classe de substances de nature organique, dans des molécules dont le groupe carbonyle (C = O) est lié à deux radicaux carbonés.
Dans leur structure, les cétones sont proches des aldéhydes et des acides carboxyliques. Cependant, ils contiennent à la fois deux atomes C (carbone ou carbone) reliés à C = O. 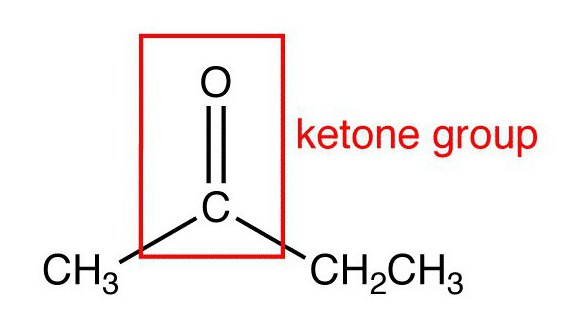
Formule
La formule générale pour les substances de cette classe est la suivante: R 1 -CO-R 2 .
Pour le rendre plus compréhensible, en règle générale, il est écrit comme ceci. 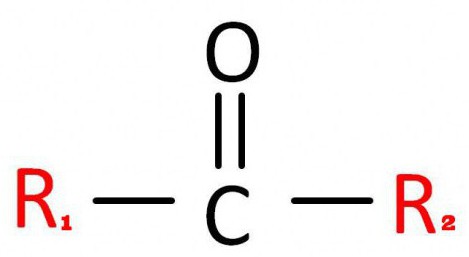
Dans celui-ci, C = O est un groupe carbonyle. A R 1 et R 2 Sont les radicaux de carbone. À leur place, il peut y avoir différents composés, mais ils doivent contenir du carbone.
Aldéhydes et cétones
Les propriétés physiques et chimiques de ces groupes de substances sont assez similaires. Pour cette raison, ils sont souvent traités ensemble. 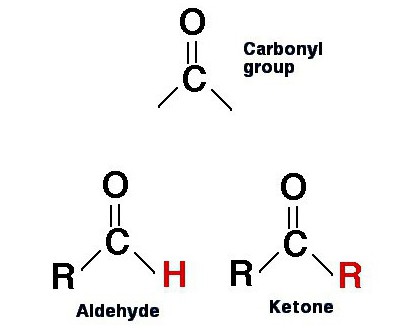
Le fait est que les aldéhydes contiennent également un groupe carbonyle dans leurs molécules. Chez eux avec des cétones, même les formules sont très similaires. Cependant, si C = O est attaché à 2 radicaux dans les substances considérées, il n'a qu'un seul aldéhyde, au lieu du second – un atome d'hydrogène: R-CO-H.
Un exemple est la formule pour une substance de cette classe, le formaldéhyde, mieux connu de tous comme formol. 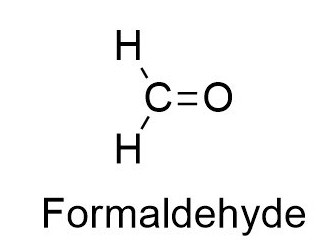
Sur la base de la formule CH 2 O, on constate que son groupe carbonyle est associé non seulement à un mais à deux atomes de H.
Propriétés physiques
Avant de traiter les propriétés chimiques des aldéhydes et des cétones, il convient de considérer leurs caractéristiques physiques. 
- Les cétones sont des matières solides à faible fusion ou des liquides avec une volatilité. Les représentants les plus bas de cette classe sont très solubles dans H 2 O et interagissent bien avec des solvants d'origine organique.
Les représentants individuels (par exemple, CH 3 COCH 3 ) sont remarquablement solubles dans l'eau et dans toutes les proportions.
Contrairement aux alcools et aux acides carboxyliques, les cétones ont une volatilité plus élevée, avec le même poids moléculaire. Cela est facilité par l'incapacité de ces composés à créer des liaisons avec H, tout comme H-CO-R. - Différents types d'aldéhydes peuvent résider dans différents états agrégés. Ainsi, les R-CO-H plus élevés sont des solides insolubles. Les plus bas sont des liquides, dont certains sont parfaitement mélangés avec H 2 O, mais certains d'entre eux ne sont que solubles dans l'eau, mais pas plus.
Le plus simple des substances de ce type – aldéhyde formique – est un gaz qui a une odeur piquante. Cette substance est hautement soluble dans H 2 O.
Les cétones les plus célèbres
Il existe de nombreuses substances R 1 -CO-R 2 , mais pas beaucoup d'entre elles sont connues. Tout d'abord, c'est la diméthylcétone, que nous connaissons tous comme l'acétone. 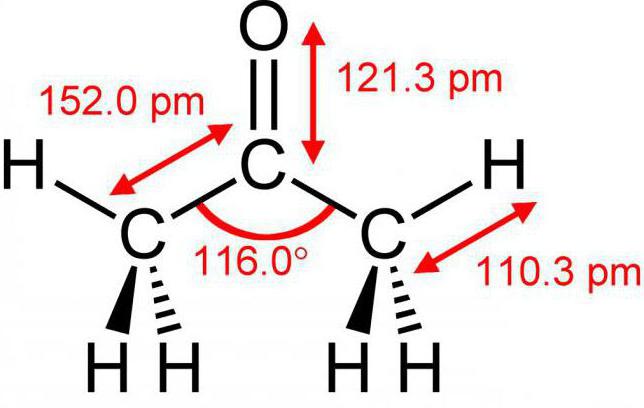 Aussi son collègue-solvant-butanone ou comme il est bien appelé – méthyl éthyl cétone.
Aussi son collègue-solvant-butanone ou comme il est bien appelé – méthyl éthyl cétone.
Parmi les autres cétones, dont les propriétés chimiques sont activement utilisées dans l'industrie – l'acétophénone (méthylphénylcétone). Contrairement à l'acétone et à la butanone, son odeur est plutôt agréable, en raison de ce qu'elle sert à la parfumerie.
Par exemple, la cyclohexanone se réfère à des représentants typiques de R 1 -CO-R 2 et est le plus couramment utilisé dans la fabrication de solvants.
Il est impossible de ne pas mentionner les dicotones. Ce nom est R 1 -CO-R 2 , dans lequel pas un, mais deux groupes carbonyle dans la composition. Ainsi, leur formule ressemble à: R 1 -CO-CO-R 2 . L'un des plus simples, mais largement utilisés dans les représentants de l'industrie alimentaire des dicétones est la diacétyle (2,3-butanedione).
Les substances énumérées ne sont qu'une petite liste de cétones synthétisées par les scientifiques (les propriétés chimiques sont discutées ci-dessous). En fait, il y en a plus, mais pas tous ont été utilisés. En particulier, il convient de considérer que beaucoup d'entre eux sont toxiques.
Propriétés chimiques des cétones
Les substances de cette catégorie peuvent réagir avec diverses substances. Ce sont précisément leurs propriétés chimiques spécifiques.
- Les cétones sont capables de joindre H (réaction d'hydrogénation). Cependant, pour la production de cette réaction, la présence de catalyseurs sous forme d'atomes métalliques de nickel, de cobalt, de cuprum, de platine, de palladium et autres est nécessaire. En raison de la réaction, R 1 -CO-R 2 est évolué vers des alcools secondaires.
De plus, en interagissant avec un hydrogène en présence de métaux alcalins ou d'amalgame Mg à partir de cétones, on obtient des glycols. - Les cétones qui ont au moins un atome d'hydrogène alpha, en règle générale, sont affectées par la tautomérisation du céto-énol. Il est catalysé non seulement avec des acides, mais aussi avec des bases. Habituellement, la forme keto est un phénomène plus stable que l'énol. Cet équilibre permet de synthétiser les cétones par hydratation des alcynes. La stabilisation relative de la forme énol-céto par conjugaison conduit à une acidité assez forte de R 1 -CO-R 2 (par rapport aux alcanes).
- Ces substances peuvent réagir avec de l'ammoniac. Cependant, ils procèdent très lentement.
- Les cétones interagissent avec l'acide hydrocyanique. En conséquence, des hydroxynitriles α, dont la saponification favorise l'apparition d'acides α-hydroxy.
- La réaction avec des halogénures d'alkylmagnésium conduit à la formation d'alcools secondaires.
- Adhésion à NaHSO 3 Favorise l'émergence de dérivés d'hydrosulfite (bisulfite). Il convient de rappeler que seules les méthyl cétones peuvent réagir dans une série grasse.
En plus des cétones, les aldéhydes peuvent également interagir avec l'hydrosulfite de sodium.
Lorsqu'il est chauffé avec une solution de NaHC03 (bicarbonate de soude) ou d'acide minéral, les dérivés de NaHSO 3 peuvent se décomposer, accompagnés de la libération d'une cétone libre. - Au cours de la réaction, R 1 -CO-R 2 Avec NH 2 OH (hydroxylamine), les cétoximes sont formées et en tant que sous-produit – H 2 O.
- Dans les réactions impliquant l'hydrazine, on forme des hydrazones (le rapport des substances prises est de 1: 1) ou de l'azine (1: 2).
Si le produit (hydrazone) produit par la réaction réagit avec l'hydroxyde de potassium sous l'effet de la réaction, N et les hydrocarbures ultimes seront libérés. Ce processus s'appelle la réaction de Kizhner. - Comme déjà mentionné ci-dessus, les aldéhydes et les cétones ont des propriétés chimiques et le processus de production est similaire. Dans ce cas, les acétals R 1 -CO-R 2 sont plus complexes que les acétals R-CO-H. Ils apparaissent à la suite de l'action sur les cétones d'éthers d'acides orthoformiques et orthosiliciques.
- Dans des conditions avec une concentration plus élevée d'alcalis (par exemple, lorsqu'ils sont chauffés avec H₂SO₄ concentré), R 1 -CO-R 2 subit une déshydratation intermoléculaire avec la formation de cétones insaturées.
- Si des alcalis sont présents dans la réaction avec R 1 -CO-R 2 , les cétones sont soumises à une condensation d'aldol. En conséquence, on forme des ß-cétoalcools qui peuvent facilement perdre la molécule de H 2 O.
- Les propriétés chimiques des cétones sont très indicatives dans le cas de l'acétone, qui a réagi avec l'oxyde de mésityle. Dans ce cas, une nouvelle substance appelée "forron" est formée.
- En outre, les propriétés chimiques de la matière organique considérée sont la réaction de Leukart-Wallach, qui favorise la réduction des cétones.
A partir de laquelle R1-CO-R2
Ayant pris connaissance des propriétés des substances considérées, il vaut la peine de trouver les méthodes les plus courantes pour leur synthèse.
- L'une des réactions les plus connues pour la préparation de cétones est l'alkylation et l'acylation de composés aromatiques en présence de catalyseurs acides (AlCl 3 , FeCI 3 , acides minéraux, oxydes, résines échangeuses de cations, etc.). Cette méthode est connue comme la réaction de Friedel-Crafts.
- Les cétones sont synthétisées par l'hydrolyse des cétimines et des vic-diols. Dans le cas de ce dernier, la présence d'acides minéraux comme catalyseurs est nécessaire.
- Aussi pour la préparation de cétones, on utilise l'hydratation d'homologues d'acétylène ou, comme on l'appelle, la réaction de Kucherov.
- Réactions Guben-Gesha.
- La cyclisation de Ruzicka convient à la synthèse des cycloketones.
- Ces substances sont également extraites du peroxy ester tertiaire à l'aide de la réarrangement Krieg.
- Il existe plusieurs manières de synthétiser les cétones lors des réactions d'oxydation des alcools secondaires. Selon le composé actif, quatre réactions sont identifiées: Swern, Kornblum, Kori-Kim et Parik-Deringa.
Champ d'application
Ayant traité les propriétés chimiques et la production de cétones, il vaut la peine de savoir où ces substances sont utilisées. 
Comme mentionné ci-dessus, la plupart d'entre eux sont utilisés dans l'industrie chimique comme solvants pour vernis et émaux, ainsi que pour la production de polymères.
De plus, certains R 1 -CO-R 2 Ils ne se sont pas avérés être des saveurs. Dans cette capacité, les cétones (benzophénone, acétophénone et autres) sont utilisées dans la parfumerie et la cuisine.
De plus, l'acétophénone est utilisé comme composant pour la prise de somnifères. 
La benzophénone, en raison de sa capacité à absorber les rayonnements nocifs, est un ingrédient fréquent des cosmétiques anti-soleil et, en même temps, un conservateur.
Effets de R1-CO-R2 sur le corps
Ayant appris que les composés sont appelés cétones (propriétés chimiques, application, synthèse et autres données à leur sujet), il convient de connaître les caractéristiques biologiques de ces substances. En d'autres termes, pour savoir comment ils agissent sur les organismes vivants.
Malgré l'utilisation assez fréquente de R 1 -CO-R 2 Dans l'industrie, il convient de rappeler que de tels composés sont très toxiques. Beaucoup d'entre eux ont des propriétés cancérogènes et mutagènes.
Les représentants spéciaux sont susceptibles d'irriter les muqueuses, jusqu'à brûler. Alicyclique R 1 -CO-R 2 Peut affecter le corps comme drogue.
Cependant, toutes les substances de ce genre ne sont pas nocives. Le fait est que certains d'entre eux participent activement au métabolisme des organismes biologiques.
De même, les cétones sont des marqueurs originaux des violations du métabolisme du carbone et de la carence en insuline. Dans l'analyse de l'urine et du sang, la présence de R 1 -CO-R 2 indique divers troubles métaboliques, y compris l'hyperglycémie et la cetoacidose.










