L' acide phosphorique, dans laquelle la formule H 3 PO 4, également appelé phosphorique. Le composé dans des conditions normales est un état d'agrégat solide. De petits cristaux de la substance est incolore. L'acide est facilement soluble dans l'eau, l'éthanol et d'autres solvants organiques. A l'état solide et liquide, les molécules de la substance de l'association de 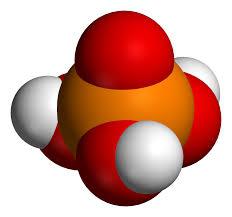 par des liaisons hydrogène et, pour cette raison, il a concentré H3PO4 une viscosité accrue. Le point d'ébullition de 42,3 C, tandis que par chauffage à 213 C est l' acide pyrophosphorique H 4 P 2 O 7.
par des liaisons hydrogène et, pour cette raison, il a concentré H3PO4 une viscosité accrue. Le point d'ébullition de 42,3 C, tandis que par chauffage à 213 C est l' acide pyrophosphorique H 4 P 2 O 7.
L'acide phosphorique est une force de support d'électrolyte ainsi que l'acide tribasique, il se dissocie en trois étapes par étapes dans des solutions aqueuses.
Préparé acide orthophosphorique habituellement un sel de celui – ci contenus dans les minerais de phosphate – apatite et de phosphore, sous l'influence de l' acide sulfurique. En outre, par hydratation de l' oxyde de phosphore (V) par hydrolyse ou un composé inorganique – le pentachlorure de phosphore.
 L' acide phosphorique est mis à réagir avec des bases, des oxydes métalliques, des sels, des métaux actifs et les acides forts. Lors de l'interaction avec la réaction de neutralisation se produit des hydroxydes, dont le résultat est la formation d'un sel et de l'eau. La réaction avec des oxydes métalliques forment également des sels et de l'eau. Lors de la réaction avec la réaction d'échange de sels a lieu, qui est obtenu lorsque le nouveau sel et de l'acide. La réaction de l' acide orthophosphorique avec du nitrate d'argent (sel) est une réaction qualitative, ce qui permet de détecter ses solutions. Total partiel – précipité jaune – phosphate d' argent (Ag 3 PO 4). Etant donné que les métaux actifs, qui sont parmi Beketova jusqu'à hydrogène entre dans des réactions de substitution. Interagir avec les acides forts (de blanchiment) présente une double nature (amphotère) et forme des sels complexes – phosphoryle. En outre, le composé peut être décomposé thermiquement à l'acide diphosphorique.
L' acide phosphorique est mis à réagir avec des bases, des oxydes métalliques, des sels, des métaux actifs et les acides forts. Lors de l'interaction avec la réaction de neutralisation se produit des hydroxydes, dont le résultat est la formation d'un sel et de l'eau. La réaction avec des oxydes métalliques forment également des sels et de l'eau. Lors de la réaction avec la réaction d'échange de sels a lieu, qui est obtenu lorsque le nouveau sel et de l'acide. La réaction de l' acide orthophosphorique avec du nitrate d'argent (sel) est une réaction qualitative, ce qui permet de détecter ses solutions. Total partiel – précipité jaune – phosphate d' argent (Ag 3 PO 4). Etant donné que les métaux actifs, qui sont parmi Beketova jusqu'à hydrogène entre dans des réactions de substitution. Interagir avec les acides forts (de blanchiment) présente une double nature (amphotère) et forme des sels complexes – phosphoryle. En outre, le composé peut être décomposé thermiquement à l'acide diphosphorique.
 l'acide phosphorique, dont l'utilisation est largement, largement utilisé dans de nombreuses industries. Par exemple, dans l'agriculture, en particulier pour la production d'engrais contenant du phosphore. Ces engrais peuvent améliorer non seulement la productivité, mais aussi une incidence favorable sur la composition microbiologique du sol, ce qui contribue au développement et à la prolifération des bactéries bénéfiques, ainsi que d'augmenter la rusticité des cultures. Dans l'industrie alimentaire l'acide utilisé comme additif alimentaire E 338, qui est contenu dans une petite quantité dans la marmelade, le sirop et les boissons gazeuses. Il est parce que la teneur en acide phosphorique et l'acide citrique dans les boissons lorsque l'utilisation excessive se produit la destruction de la dent. Cette propriété ramollir l'émail et de la dentine a été utilisé par les dentistes. Par exemple, l'acide phosphorique contenant une pâte spéciale est appliquée à une dent avant le remplissage de celui-ci et contribue à un tissu déminéralisation. La substance est utilisée pour le traitement des semences et la mise en place de peintures de bois non combustible et des vernis et des matériaux de construction (plaque de fosfodrevesnye mousse de phosphate non inflammable). Activement utilisé dans le brasage de cuivre, les métaux ferreux, l'acier inoxydable comme nettoyant qui élimine de la surface des différents oxydes métalliques. Également utilisé dans décalaminage, un détergent et de la biologie moléculaire.
l'acide phosphorique, dont l'utilisation est largement, largement utilisé dans de nombreuses industries. Par exemple, dans l'agriculture, en particulier pour la production d'engrais contenant du phosphore. Ces engrais peuvent améliorer non seulement la productivité, mais aussi une incidence favorable sur la composition microbiologique du sol, ce qui contribue au développement et à la prolifération des bactéries bénéfiques, ainsi que d'augmenter la rusticité des cultures. Dans l'industrie alimentaire l'acide utilisé comme additif alimentaire E 338, qui est contenu dans une petite quantité dans la marmelade, le sirop et les boissons gazeuses. Il est parce que la teneur en acide phosphorique et l'acide citrique dans les boissons lorsque l'utilisation excessive se produit la destruction de la dent. Cette propriété ramollir l'émail et de la dentine a été utilisé par les dentistes. Par exemple, l'acide phosphorique contenant une pâte spéciale est appliquée à une dent avant le remplissage de celui-ci et contribue à un tissu déminéralisation. La substance est utilisée pour le traitement des semences et la mise en place de peintures de bois non combustible et des vernis et des matériaux de construction (plaque de fosfodrevesnye mousse de phosphate non inflammable). Activement utilisé dans le brasage de cuivre, les métaux ferreux, l'acier inoxydable comme nettoyant qui élimine de la surface des différents oxydes métalliques. Également utilisé dans décalaminage, un détergent et de la biologie moléculaire.
L'acide phosphorique se trouve une utilisation active et diversifiée en raison de leurs propriétés physico-chimiques et préparation relativement faible coût.








