des sources de courant , chimique (HIT abrégé) – adaptation, dans lequel l'énergie d'une réaction rédox est convertie en énergie électrique. Leurs autres noms – une électrochimique cellule, cellule galvanique , une cellule électrochimique. Leur principe de fonctionnement est le suivant: l'interaction des deux réactifs provoque une réaction chimique avec une allocation d'alimentation en courant électrique constant. Dans un autre processus source de génération de courant électrique se produit système à plusieurs étages. D' abord libéré l' énergie thermique, il se transforme en mécanique et alors seulement en énergie électrique. Avantage HIT – procédé en une étape, à savoir l'électricité est obtenu directement, sans passer par les étapes consistant à fournir thermiques et énergies mécaniques.

histoire
Comment la première source de courant? sources chimiques ont été appelés cellules galvaniques après le savant italien du XVIIIe siècle – Luigi Galvani. Il était un médecin, anatomiste, physiologiste et physicien. L'un des domaines de sa recherche était d'étudier les réactions des animaux à diverses influences extérieures. La méthode chimique de production d'électricité a été ouvert Galvani accidentellement, lors d'une de ses expériences sur les grenouilles. Il est relié à un point sensible dans les jambes de la grenouille deux plaques métalliques. Lorsque cela se produisait la contraction musculaire. Propre explication de ce phénomène de Galvani a eu tort. Mais les résultats de ses expériences et observations ont aidé à son compatriote Alessandro Volta dans des études ultérieures.
Volta a exposé dans son travail la théorie de l'apparition du courant électrique à travers une réaction chimique entre deux métaux en contact avec le tissu musculaire de la grenouille. La première source de courant chimique ressemblait à un récipient avec de la saumure, avec des plaques immergées dans celle-ci de zinc et de cuivre.
Dans le CSC à l'échelle industrielle a commencé à produire dans la seconde moitié du XIXe siècle, grâce au Français Leklanshe qui a inventé les cellules de manganèse et de zinc primaire avec électrolyte de sel, qui porte son nom. Après quelques années, cela a été amélioré cellule électrochimique à d'autres scientifiques et sont les seules sources chimiques primaires de l'électricité avant 1940.
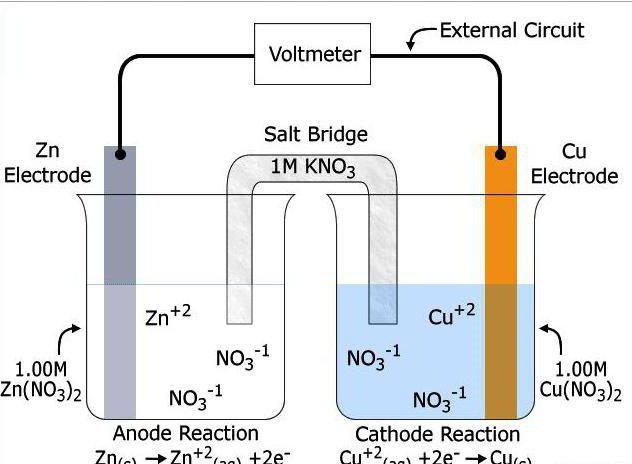
Conception et fonctionnement HIT
Dispositif de source de courant chimique comprend deux électrodes (conducteurs du premier type) et l'électrolyte intermédiaire (conducteur du second type, ou d'un conducteur d'ions). A la frontière du potentiel électronique se pose entre eux. L'électrode à laquelle l'agent réducteur est oxydé appelée l'anode, et celui où la récupération de l'oxydant – cathode. Ensemble avec l'électrolyte, ils constituent un système électrochimique.
Un sous-produit de la réaction d'oxydo-réduction entre les électrodes est l'apparition d'un courant électrique. Au cours de cette réaction, l'agent réducteur est oxydé et oxydant donne les électrons qui les accepte et en raison de c'est remis en état. La présence de l'électrolyte entre la cathode et l'anode est une réaction préalable. Si mélanger simplement ensemble des poudres de deux métaux différents, aucune décharge électrique ne se produit pas, toute l'énergie sera libérée sous forme de chaleur. L'électrolyte est nécessaire de simplifier le processus de transfert d'électrons. Le plus souvent agit solution de sel ou fusion de sa qualité.
Les électrodes ressemblent plaque métallique ou une grille. Lors de leur immersion dans l'électrolyte provient d'une différence de potentiel électrique entre eux – la tension en circuit ouvert. L'anode a une tendance à l'impact des électrons et une cathode – à leur adoption. Sur leur réaction chimique surface commence. Ils se sont arrêtés par l'ouverture de la chaîne, ainsi que lorsque l'un des réactifs consommés. La rupture a lieu par le retrait de l'une des électrodes ou de l'électrolyte.

systèmes électrochimiques Composition
sources de courant oxydants chimiques sont utilisés comme sels d'acides d'oxygène, l' oxygène, des halogénures, des oxydes de métaux plus élevés composé nitroorganic et t. D. Les agents réducteurs qui y sont des métaux et leurs oxydes inférieurs, de l' hydrogène et des composés hydrocarbonés. Comme électrolytes utilisés:
- Les solutions aqueuses d'acides, alcalins, le sel et ainsi de suite. D.
- des solutions non aqueuses ayant une conductivité ionique obtenue par dissolution du sel dans des solvants organiques ou inorganiques.
- sel fond.
- Les composés solides avec réseau ionique, dans lequel un des ions mobiles.
- électrolytes Matrix. Ces solutions liquides ou de masses fondues sont situés dans les pores d'un corps solide non conducteur – elektronositelya.
- électrolytes échangeurs d'ions. Cette liaison solide avec les groupes ioniques fixes du même signe. un autre signe de Jonas tout en restant mobile. Cette propriété rend la conductivité de l'électrolyte unipolaires.

batterie galvanique
sources de courant chimiques se composent de cellules électrochimiques – cellules. La tension dans une de ces cellules est faible – de 0,5 à 4V. En fonction des besoins, HIT utiliser la batterie galvanique, composée de plusieurs éléments connectés en série. Il est parfois utilisé en parallèle ou en connexion en série-parallèle de plusieurs éléments. Dans un circuit de série comprennent toujours que les mêmes piles ou batteries. Ils doivent avoir les mêmes paramètres sont les suivants: système électrochimique, la conception, la variation et la taille processus. Pour la connexion en parallèle est possible d'utiliser des éléments de différentes tailles.

classification HIT
Sources chimiques diffèrent:
- la taille;
- construction;
- réactifs;
- Nature réaction energoobrazuyuschey.
Ces paramètres définissent les performances des CCS appropriées pour une application particulière.
Classification des cellules électrochimiques basées sur des différences de principe de fonctionnement. En fonction de ces caractéristiques, distinguer:
- sources chimiques primaires – articles à usage unique. Ils ont un certains réactifs de stock, qui est consommé dans la réaction. Après une telle cellule pleine de décharge perd de son efficacité. Dans un autre HIT primaire est appelé cellules galvaniques. Fidèle simplement les appeler – l'élément. L'exemple le plus simple d'une source d'énergie primaire – AA « de la batterie ».
- sources de courant chimiques rechargeables – batteries (également appelées HIT secondaire, réversible) sont des éléments réutilisables. En faisant passer un courant à partir du circuit extérieur dans le sens inverse à travers la batterie après une décharge complète de réactifs usés sont à nouveau régénérés au accumuler de l'énergie chimique (de charge). En raison de la possibilité de charge à partir d'un dispositif de source de courant constant externe est utilisé pendant une longue période, par intermittence pour recharger. Le procédé de génération d'énergie électrique est appelée la décharge de l'accumulateur. Ceux-ci comprennent des batteries de HIT de nombreux appareils électroniques (ordinateurs portables, téléphones mobiles et ainsi de suite. N.).
- sources chimiques thermiques – dispositifs d'action continue. Au cours de leur fonctionnement il y a un flux continu de nouveaux lots de réactifs et d'élimination des produits de réaction.
- Les cellules électrochimiques combinées (polutoplivnyh) ont un point sur l'un des réactifs. Le second dispositif est fourni à l'extérieur. La durée de vie de l'appareil dépend de la fourniture du premier réactif. sources chimiques combinées de courant électrique sont utilisés comme batteries, s'il y a la possibilité de restaurer leur charge par le courant passant d'une source externe.
- HIT renouvelable rechargée mécaniquement ou chimiquement. Pour eux, il est possible de remplacer après une charge complète passé réactifs sur de nouvelles portions. Autrement dit, ils ne sont pas des dispositifs continus et, comme les batteries périodiquement rechargées.

caractéristiques HIT
Les principales caractéristiques des sources d'énergie chimiques comprennent:
- Tension de circuit ouvert (OCV ou une tension de décharge). Ce taux dépend principalement du système électrochimique (combinaison d'un agent réducteur, l'agent oxydant et l'électrolyte). Aussi OCV affecte la concentration de l'électrolyte, le degré de décharge, de la température et d'autres. OCV dépend de la valeur du courant circulant dans le HIT.
- Puissance.
- Le courant de décharge – en fonction de la résistance du circuit extérieur.
- Capacité – le montant maximum de l'électricité qui donne HIT lorsqu'elle est complètement déchargée.
- La teneur en énergie – énergie maximale reçue dans le dispositif de décharge complète.
- Caractéristiques de l'énergie. Pour les batteries, il est principalement garanti nombre de cycles de charge-décharge sans abaisser la capacité de tension ou de charge (ressource).
- performance Plage de température.
- Durée de conservation – la quantité maximale de temps entre la fabrication et le premier dispositif de décharge.
- Durée de vie – le stockage total maximum et la vie professionnelle. Pour les piles à combustible sont des périodes de service importantes avec un fonctionnement continu et intermittent.
- L'énergie totale délivrée pour toute la durée de vie.
- résistance mécanique par rapport aux vibrations, aux chocs, et ainsi de suite. N.
- Capacité à travailler en toute position.
- Fiabilité.
- Facile d'entretien.
Exigences pour HIT
La conception des cellules électrochimiques devrait fournir un environnement propice à la réaction la plus efficace. Ces conditions comprennent:
- empêcher les fuites de courant;
- travail uniforme;
- résistance mécanique (y compris étanchéité);
- la séparation des réactifs;
- un bon contact entre les électrodes et l'électrolyte;
- courant de décharge de la zone de réaction à une sortie externe avec un minimum de pertes.
Les sources du courant doivent satisfaire aux conditions générales suivantes:
- les valeurs les plus élevées de paramètres spécifiques;
- plage de température maximale de fonctionnement;
- le plus grand effort;
- le coût minimum d'une unité d'énergie;
- stabilité tension;
- exiger la conservation;
- la sécurité;
- facilité d'entretien, et idéalement pas besoin;
- longue durée de vie.
HIT de fonctionnement
Le principal avantage des cellules primaires – pas besoin d'aucun entretien. Avant de commencer à les utiliser assez pour vérifier l'apparence, la durée de vie. Lorsqu'il est connecté, il est important d'observer la polarité et vérifier l'intégrité des contacts de l'appareil. sources chimiques plus complexes – batteries, exigent un soin plus sérieux. Le but de leur service – l'extension maximale de la vie. Prendre soin de la batterie est:
- le maintien de la propreté;
- surveillance de la tension de circuit ouvert;
- le maintien du niveau d'électrolyte (seulement pour le remplissage de l'eau distillée peut être utilisé);
- Le contrôle de la concentration de l'électrolyte (par l'intermédiaire hydromètre – dispositif simple permettant de mesurer la densité du fluide).
Pendant le fonctionnement des cellules électrochimiques doivent se conformer à toutes les exigences relatives à l'utilisation sécuritaire des appareils électriques.
HIT Classification des systèmes électrochimiques
Types de sources de courant chimiques, selon le système:
- plomb (acide);
- nickel-cadmium, nickel-fer, nickel-zinc;
- manganèse-zinc, cuivre-zinc, le mercure, le zinc, le chlorure de zinc;
- argent-zinc, d'argent et de cadmium;
- air-métal;
- nickel-hydrogène et de l'argent de l'hydrogène;
- de manganèse et de magnésium;
- le lithium et le t. d.
L'utilisation moderne de HIT
Les sources du courant Il est actuellement utilisé dans:
- véhicules;
- des dispositifs portatifs;
- la technologie militaire et de l'espace;
- équipements scientifiques;
- Médecine (stimulateur cardiaque).
Des exemples connus de HIT dans la maison:
- les piles (piles sèches);
- batteries appareils ménagers portables et de l'électronique;
- alimentation de secours;
- batteries de voiture.
En particulier, largement adopté les sources chimiques lithium d'électricité. Cela est dû au fait que le lithium (Li) a la densité d'énergie plus élevée. Le fait qu'il possède le négatif potentiel de l' électrode de tous les autres métaux. Les batteries au lithium-ion (LIA) devant toutes les autres valeurs de CCS et l'énergie spécifique de la tension de travail. Maintenant, ils maîtrisent progressivement une nouvelle sphère – le transport routier. Dans les développements scientifiques futurs liés à l'amélioration des batteries au lithium, se déplace dans la direction des modèles ultraminces et les grandes batteries lourdes.








