Quelle est la valence du soufre? valences possibles de soufre
Soufre (soufre lat.) – élément non métallique. Le symbole chimique S, le numéro de série dans le tableau périodique – 16 soufre Valence a été mis en avant même d'étudier la structure de l'atome. Sa valeur est déterminée en fonction des propriétés de remplacement, d'attirer ou de joindre un certain nombre d'autres atomes ou groupes. Plus tard, les chercheurs ont découvert un rôle de particules chargées négativement (électrons) en cas d' une liaison chimique.
Valence de soufre: où les atomes particulier affecte sa valeur?
La plupart élément chimique commun sur la Terre est au 16e rang. Il se présente sous forme de cristaux jaune vif ou de poudre dans les roches à proximité de volcans actifs et inactifs. Les plus connus composés naturels – sulfures et sulfates.

Caractéristiques des éléments et substances:
- nonmétal forte.
- Par électronégativité (EO) ou de la capacité d'attirer des rendements en soufre des électrons seulement le fluor, l'oxygène, l'azote, le chlore et le brome.
- Il réagit avec les métaux et non-métaux, composés simples et complexes.
Les différences dans les propriétés dépendent de la structure et de l'état de l'atome, la différence entre les valeurs de EO. Voyons ce qui peut être une valence de composés de soufre. Leur comportement chimique dépend de la structure des enveloppes de puissance, le nombre et la disposition des électrons externes à l'atome.
Pourquoi est différent valences?
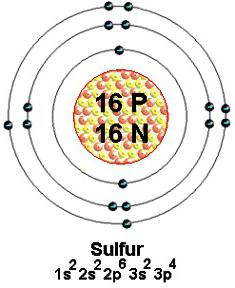 Les isotopes stables sont le soufre naturel avec des nombres de masse de 32 (le plus courant), 33, 34 et 36. Chacun de ces atomes nucléides 16 contient des protons chargés positivement. Dans l'espace près du noyau se déplacer avec une vitesse énorme de 16 électrons. Ils sont infiniment petit, chargé négativement. Moins attiré vers le noyau (6) plus lâche des particules externes. Plusieurs ou tous sont impliqués dans la formation de différents types de liaison chimique. Selon les concepts modernes valence de soufre est déterminée par le nombre d'créés commune (liaison) des paires d'électrons. illustrations habituellement des particules extérieures participant au processus, représenté par un point autour d'un symbole chimique.
Les isotopes stables sont le soufre naturel avec des nombres de masse de 32 (le plus courant), 33, 34 et 36. Chacun de ces atomes nucléides 16 contient des protons chargés positivement. Dans l'espace près du noyau se déplacer avec une vitesse énorme de 16 électrons. Ils sont infiniment petit, chargé négativement. Moins attiré vers le noyau (6) plus lâche des particules externes. Plusieurs ou tous sont impliqués dans la formation de différents types de liaison chimique. Selon les concepts modernes valence de soufre est déterminée par le nombre d'créés commune (liaison) des paires d'électrons. illustrations habituellement des particules extérieures participant au processus, représenté par un point autour d'un symbole chimique.
Comme une valence dépend de la structure de l'atome?
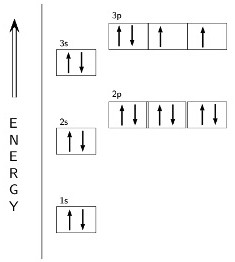 Avec la structure peut présenter des niveaux et des sous-niveaux (s, p, d) en utilisant le diagramme d'énergie à partir de laquelle la valence du soufre répond à la formule dépendante. Deux flèches de directions opposées symbolisent appairés, un – électrons non appariés. L'atome de soufre de l'espace extérieur sous forme de particules orbitales 6 et 8 est nécessaire pour la stabilité de la règle de l'octet. configuration du shell Valence reflète la formule 3s23p4. Couche inachevée Électrons ont une grande réserve d'énergie, ce qui provoque l'état instable de l'atome. Afin d'atteindre la stabilité de l'atome de soufre nécessite deux particules négatives supplémentaires. Ils peuvent être obtenus au cours de la formation de liaisons covalentes avec d' autres éléments ou en raison de l'absorption de deux électrons libres. Dans ce cas, le soufre est une valence II (-). La même valeur peut être obtenue en utilisant la formule: 8 – 2 = 6, où 6 – est le numéro du groupe dans lequel l'élément.
Avec la structure peut présenter des niveaux et des sous-niveaux (s, p, d) en utilisant le diagramme d'énergie à partir de laquelle la valence du soufre répond à la formule dépendante. Deux flèches de directions opposées symbolisent appairés, un – électrons non appariés. L'atome de soufre de l'espace extérieur sous forme de particules orbitales 6 et 8 est nécessaire pour la stabilité de la règle de l'octet. configuration du shell Valence reflète la formule 3s23p4. Couche inachevée Électrons ont une grande réserve d'énergie, ce qui provoque l'état instable de l'atome. Afin d'atteindre la stabilité de l'atome de soufre nécessite deux particules négatives supplémentaires. Ils peuvent être obtenus au cours de la formation de liaisons covalentes avec d' autres éléments ou en raison de l'absorption de deux électrons libres. Dans ce cas, le soufre est une valence II (-). La même valeur peut être obtenue en utilisant la formule: 8 – 2 = 6, où 6 – est le numéro du groupe dans lequel l'élément.
Lorsqu'il y a des composés dans lesquels la valence du soufre est II (-)?
 Element attire ou prend complètement les électrons parmi les atomes ayant une valeur d'électronégativité inférieure selon l'échelle de Pauling. Valence II (-) est représenté sur les sulfures de métaux et non-métaux. Un vaste groupe de ces composés dans la composition des roches et des minéraux sont d' une grande importance pratique. Ceux-ci comprennent la pyrite (FES), sphalérite (ZnS), galène (PbS), et d'autres substances. cristaux de sulfure de fer ont une couleur tan agréable et le lustre. La pyrite minérale « amour de l'or » est souvent appelé. porté calciner ou à la réduction des métaux de leurs minerais. Le sulfure d'hydrogène H2S a les mêmes structures électroniques, tels que l'eau. L'origine de H2S:
Element attire ou prend complètement les électrons parmi les atomes ayant une valeur d'électronégativité inférieure selon l'échelle de Pauling. Valence II (-) est représenté sur les sulfures de métaux et non-métaux. Un vaste groupe de ces composés dans la composition des roches et des minéraux sont d' une grande importance pratique. Ceux-ci comprennent la pyrite (FES), sphalérite (ZnS), galène (PbS), et d'autres substances. cristaux de sulfure de fer ont une couleur tan agréable et le lustre. La pyrite minérale « amour de l'or » est souvent appelé. porté calciner ou à la réduction des métaux de leurs minerais. Le sulfure d'hydrogène H2S a les mêmes structures électroniques, tels que l'eau. L'origine de H2S:
- est libéré lors de la décomposition de protéines (par exemple, des oeufs de poulet);
- Il entre en éruption avec des gaz volcaniques;
- Il accumule dans les eaux naturelles, l'huile;
- publié dans les vides dans la croûte terrestre.
Pourquoi la formule SO2 valent d'oxyde de soufre?
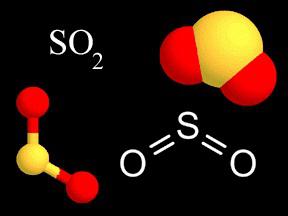 dioxyde de formule indique qu'un atome de soufre dans une molécule liée à deux atomes d'oxygène, dont chacun doit être de 2 à l'octet d'électrons. La liaison résultante est par nature un covalente polaire (EO plus d'oxygène). La valence du soufre dans ce composé a une valeur de IV (+), parce que l'électron de l'atome de soufre 4 sont déplacés vers les deux atomes d'oxygène. La formule peut être écrite comme: S2O4, mais selon les règles doit être réduite de dioxyde 2. lorsqu'il est dissous dans l'eau, forme des ions d'acide sulfureux sont faibles. Ses sels – Sulfites – agents réducteurs forts. gaz SO2 est un intermédiaire dans la production d'acide sulfurique.
dioxyde de formule indique qu'un atome de soufre dans une molécule liée à deux atomes d'oxygène, dont chacun doit être de 2 à l'octet d'électrons. La liaison résultante est par nature un covalente polaire (EO plus d'oxygène). La valence du soufre dans ce composé a une valeur de IV (+), parce que l'électron de l'atome de soufre 4 sont déplacés vers les deux atomes d'oxygène. La formule peut être écrite comme: S2O4, mais selon les règles doit être réduite de dioxyde 2. lorsqu'il est dissous dans l'eau, forme des ions d'acide sulfureux sont faibles. Ses sels – Sulfites – agents réducteurs forts. gaz SO2 est un intermédiaire dans la production d'acide sulfurique.
Ce qui soufre des substances présente sa plus forte valence?
 Oxyde ou SO3 S2O6 – liquide incolore à des températures inférieures à 17 ° C, il durcit. Dans le composé de SO3 est la valence de l'oxygène II (-), et le soufre VI (+). oxyde supérieur se dissout dans l' eau et forme un acide fort sulfurique dibasique. Pour un grand rôle dans le processus de production d'une substance appelée « le pain de l'industrie chimique. » rôle important dans l'économie et la médecine fait partie des sels d'acides – sulfates. Utiliser le calcium hydraté (plâtre), sodium (sel de Glauber), le magnésium ( en anglais ou sel amer).
Oxyde ou SO3 S2O6 – liquide incolore à des températures inférieures à 17 ° C, il durcit. Dans le composé de SO3 est la valence de l'oxygène II (-), et le soufre VI (+). oxyde supérieur se dissout dans l' eau et forme un acide fort sulfurique dibasique. Pour un grand rôle dans le processus de production d'une substance appelée « le pain de l'industrie chimique. » rôle important dans l'économie et la médecine fait partie des sels d'acides – sulfates. Utiliser le calcium hydraté (plâtre), sodium (sel de Glauber), le magnésium ( en anglais ou sel amer).
La formation de différents types de liaison chimique peut participer 1, 2, 3, 4, 6, les électrons externes. Nous appelons le soufre de valence possible, étant donné qu'il ya composé rare et instable: I (-), II (-), II (+), III (+), IV (+), VI (+). Un deuxième élément de valence positive acquiert le monoxyde SO. La valeur la plus courante II (-), IV (+), VI (+) représente le soufre dans la composition du groupe de substances ayant une importance industrielle, agricole et médical. Ses composés sont utilisés dans la fabrication de feux d'artifice.

Le gros problème est la capture des gaz résiduaires, y compris nocif pour l' homme et l'environnement d'oxydes de soufre IV (+), VI (+ ) et de sulfure d'hydrogène. la technologie établie pour le traitement de ces gaz d'échappement et de les obtenir à partir des sulfates de l'acide sulfurique. A cette fin, les usines chimiques construites près d'aciéries ou dans la même zone. En conséquence, la quantité de contamination est réduite, il y a moins de « pluie acide sulfurique. »