Ernest Rutherford – ce qui est l'un des fondateurs des enseignements fondamentaux de la structure interne de l'atome. Il né scientifique en Angleterre, dans une famille d'immigrants venus d'Ecosse. Rutherford était le quatrième enfant dans sa famille, en même temps avéré être le plus talentueux. La contribution spéciale qu'il pourrait apporter à la théorie de la structure atomique.

Les premières idées sur la structure de l'atome
Il convient de noter que avant la tenue de célèbres expériences de Rutherford sur la dispersion des particules alpha, dominante à cette époque l'idée de la structure de l'atome a été le modèle de Thompson. Ce scientifique était confiant que la charge positive est remplit uniformément la totalité du volume de l'atome. Les électrons chargés négativement, Thompson pensait, étaient des éclaboussures aurait en elle.

Conditions préalables à la révolution scientifique
Après avoir quitté l'école, Rutherford comme l'étudiant le plus talentueux a reçu une subvention de 50 £ pour une formation complémentaire. En raison de cela, il a pu aller à l'université en Nouvelle-Zélande. Ensuite, un examen jeune savant à l'Université de Canterbury et ont commencé sérieusement à étudier la physique et la chimie. En 1891, Rutherford a fait son premier rapport sur le thème « L'évolution des éléments. » Il a été désigné une idée pour la première fois dans l'histoire que l'atome est une structure complexe.
Puis dominé par l'idée de Dalton que les atomes sont indivisibles dans les milieux scientifiques. Ceux qui l'entouraient Rutherford, son idée semblait tout à fait fou. Jeune scientifique avait constamment des excuses à leurs collègues pour leur « substance ». Mais 12 ans plus tard, Rutherford a toujours réussi à prouver leur cas. Rutherford a eu la chance de poursuivre ses recherches au Laboratoire Cavendish en Angleterre, où il a commencé à étudier les processus d'ionisation de l'air. La première découverte de Rutherford étaient les rayons alpha et bêta.
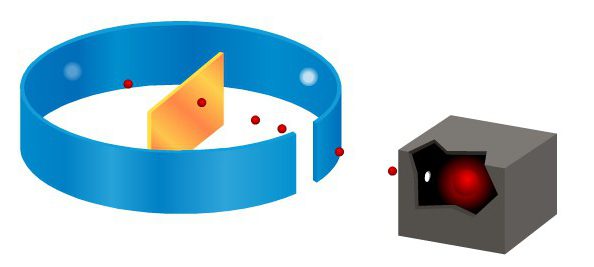
l'expérience Rutherford
En bref sur l'ouverture peut le dire: en 1912, Rutherford et ses assistants avaient son expérience célèbre – particules alpha émises par la source du plomb. Toutes les particules, sauf celles qui sont apparues plomb absorbé, se déplaçant le long d'un canal fixe. Leur incident de jet étroit sur une mince couche de papier d'aluminium. Cette ligne est perpendiculaire à la feuille. Expérience Rutherford dispersion des particules alpha a montré que les particules qui passent à travers une feuille de papier à travers, de sorte scintillation causée appelé à l'écran.
Cet écran est revêtue d'un matériau spécial qui brille lorsqu'il est frappé par une particule alpha. L'espace entre la couche de feuille d'or et l'écran a été rempli sous vide pour les particules alpha sont dispersées dans l'air. Un tel dispositif a permis aux chercheurs d'observer les particules sont dispersées à travers un angle de 150 °.
Si la feuille est pas utilisé comme un obstacle à un faisceau de particules alpha, l'écran formé un cercle lumineux de scintillations. Mais juste avant de mettre un faisceau barrière de feuille d'or, l'image a changé. Épidémie est apparu non seulement en dehors de ce cercle, mais aussi sur le côté opposé de la feuille. Expérience Rutherford dispersion des particules alpha ont montré que la majorité des particules passent à travers la feuille sans changements notables dans la trajectoire.
Cependant, certaines particules sont déviées par un angle assez grand, et même rejetés. Sur chaque 10 000 passant librement à travers une couche de particules d'or seulement une feuille dévie d'un angle supérieur à 10 ° – comme une exception de l'une des particules dévié à un angle.

La raison pour laquelle les particules alpha déviés
Quel détail considéré et enregistrer ses preuves Rutherford – structure de l'atome. Une telle position indiquant que l'atome n'est pas une formation continue. La plupart des particules passe librement à travers la feuille d'un atome d'épaisseur. Et puisque la masse des particules alpha presque 8000 fois plus grande que la masse de l'électron, ce dernier ne pouvait pas avoir un effet significatif sur la trajectoire des particules alpha. Cela pourrait se faire que par un noyau atomique – un corps de petite taille, a presque toute la masse et toute la charge électrique de l'atome. A cette époque, ce fut une percée significative physicien britannique. L'expérience de Rutherford est l'une des étapes les plus importantes dans le développement de la science de la structure interne de l'atome.
D'autres découvertes obtenues au cours de l'étude de l'atome
Ces études sont devenues des preuves directes que la charge positive de l'atome est dans son noyau. Cette région occupe un espace très faible par rapport à la taille de son intégrité. Ce petit volume de diffusion des particules alpha est apparu très peu probable. Les particules qui sont passés près du noyau atomique, testés déviations nettes de la voie, parce que la force de répulsion entre la particule alpha et le noyau atomique était très puissant. Les expériences de Rutherford sur la dispersion des particules alpha ont montré la probabilité que la particule alpha obtient directement dans le noyau. Cependant, la probabilité était très faible, mais pas nul.
Ce ne fut pas le seul fait qui est prouvé par l'expérience de Rutherford. A brièvement étudié la structure de l'atome et ses collègues, qui ont fait un certain nombre d'autres découvertes importantes. En plus d'enseigner que les particules alpha sont des noyaux d'hélium en mouvement rapide.
Le scientifique a pu décrire la structure de l'atome, dans lequel le noyau occupe une petite partie du volume total. Ses expériences ont prouvé que pratiquement toute la charge de l'atome est concentrée dans son noyau. Lorsque cela se produit les deux cas, la déviation des particules alpha et les cas de leur collision avec un noyau.

Les expériences modèle nucléaire de l'atome de Rutherford
En 1911, Rutherford après de nombreuses études a proposé un modèle de structure atomique, qu'il appelle un planétaire. Selon ce modèle, il est disposé à l'intérieur du noyau atomique qui contient presque toute la masse de la particule. Les électrons se déplacent autour du noyau de la même manière que le font les planètes autour du soleil. De leur ensemble un nuage d'électrons que l'on appelle. Atom a également une charge neutre, comme l'expérience de Rutherford.
La structure d'un atome dans l'avenir de Concerned Scientists nommé Niels Bohr. Ce fut lui qui affiné la doctrine Rutherford, parce que Bohr modèle planétaire de l'atome a commencé à faire face à des difficultés explication. Comme l'électron se déplace autour du noyau sur une orbite avec une certaine accélération, il doit tôt ou tard tomber sur le noyau d'un atome. Cependant, Niels Bohr a pu prouver que les lois de la mécanique classique ne sont plus actifs au sein de l'atome.






